
科目: 来源: 题型:
【题目】利用下图装置收集气体并验证其某些化学性质,正确的是

选项 | 气体 | 试剂② | 现象 | 结论 |
A | NH3 | 酚酞试液 | 溶液变红色 | NH3的水溶液显碱性 |
B | Cl2 | 紫色石蕊试液 | 溶液立即褪色 | Cl2有氧化性 |
C | SO2 | 溴水 | 溶液褪色 | SO2有漂白性 |
D | X(能形成酸雨) | KI淀粉溶液 | 溶液变蓝 | X是NO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)![]() 2NH3(g) △H2=-92.4kJ/mol ,有关数据及特定平衡状态见下表。
2NH3(g) △H2=-92.4kJ/mol ,有关数据及特定平衡状态见下表。
容器 | 起始投入 | 达平衡时 | ||
甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 |
乙 | amolN2 | bmolH2 | 0molNH3 | 1.2molNH3 |
(1)若平衡后同种物质的体积分数相同,起始时乙容器通入的N2的物质的量为 ,起始时乙中的压强是甲容器的 倍,乙的平衡常数为
(2)恒容密闭容器中可以发生氨气的分解反应,达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是 (选填序号)。
a | b | c | d | |
x | 温度 | 温度 | 加入H2的物质的量 | 加入氨气的物质的量 |
y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
(3)研究在其他条件不变时,改变起始物氢气的物质的量对反应的影响,实验结果如图所示(图中T表示温度,n表示物质的量):
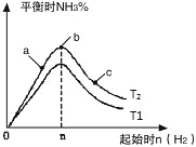
像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)。
②a、b、c三点中,N2转化率最高的是 (填字母)。
③若容器容积为1L,T2℃在起始体系中加入1molN2,3molH2,经过5min反应达到平衡时H2的转化率为60%,则NH3的反应速率为 。保持容器体积不变,若起始时向容器内放入2molN2和6molH2,达平衡后放出的热量为Q,则Q_________110.88kJ(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某原子的一种激发态为1s22s12p1,则该元素在周期表中的位置为
A. 第二周期ⅡA族 B. 第二周期ⅢA族
C. 第二周期ⅠA族 D. 第二周期ⅣA族
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:2A(g) + 3B(g) ![]() 2C(g)+D(g),在四种不同条件下的反应速率分别为:
2C(g)+D(g),在四种不同条件下的反应速率分别为:
①υ(A)=0.5mol·L-1·min-1 ②υ(B)=0.6 mol·L-1·min-1
③υ=0.35 mol·L-1·min-1 ④υ(D)=0.4 mol·L-1·min-1
该反应在这四种不同条件下反应速率由快到慢的顺序是
A. ①②③④ B. ②①④③ C. ④①②③ D. ②④①③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列状态中,可以证明可逆反应N2 + 3H2![]() 2NH3已达平衡状态是
2NH3已达平衡状态是
①一个N≡N键断裂的同时,有3个H—H键断裂
②一个N≡N键断裂的同时,有6个N—H键断裂
③其他条件不变时,体系压强不再改变
④ω(NH3)、ω(N2)和ω(H2)都不再改变
⑤恒温恒容时,密度保持不变
⑥υ正(H2)=0.03 mol·L-1·min-1,υ逆(NH3)=0.02 mol·L-1·min-1
A. 全部 B. ②③④⑥ C. ③④⑤⑥ D. ②③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列图示的说法中正确的是

A. 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱
B. 用图②所示实验装置通过排空气法收集CO气体
C. 图③所示装置可用于探究温度对H2O2分解反应速率的影响
D. 图④两个装置中通过导线的电子数相相同时,生成的H2的物质的量也相同
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学——选修5:有机化学基础】
聚碳酸酯(D)可制作车、船、飞机的挡风玻璃。由A可合成聚碳酸酯(D)及食用香精(H)合成路线如下图所示(部分反应条件略去)。已知A、B中都只有一种化学环境的氢原子。请回答下列问题:

(1)A中的官能团名称为_____________。
(2)FG的反应类型为________________。
(3)1molH最多能与_____________molH2发生反应。
(4)C的结构简式为______________。
(5)由B生成碳酸二甲酯的化学方程式为___________。
(6)G的同分异构体中,符合以下条件的有____种:①能与FeCl3溶液发生显色反应;②苯环上只有2个取代基且互为对位。其中核磁共振氢谱只有5组峰的是_______(写结构简式)。
(7)请根据题中信息设计简要合成路线以CH3C=CLi、乙醇和上述路线图中的个别物质合成1,3-戊二烯。合成路线流程图示例如下:________
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。

(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入 (填化学式)气体。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应如下:
阳极:① 4OH--4e-=O2↑+2H2O② 。
阴极:① 。②CH3CHO+2e-+2H2O=CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量 (填“增大”、“减小”或“不变”)。
(4)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填字母序号)。
a.c(Na+)不一定是c(SO42-)的2倍
b.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
c.c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
d.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(5)高纯度氧化铝是用于制备隔膜的材料,某研究小组用以下流程制取高纯度氧化铝:

①“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 。
②配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
③“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com