
科目: 来源: 题型:
【题目】KNO3和Cu(NO3)2的混合溶液200mL,其中c(NO3-)=2mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L气体(标准状况),假设电解后溶液体积不变,下列说法正确的是( )
A.原混合溶液中c(K+)=0.5mol·L-1
B.电解得到的Cu的物质的量为0.2mol
C.上述电解过程中共转移0.4mol电子
D.电解后溶液中c(H+)=2mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,在饱和氯水中存在平衡:Cl2+H2O![]() H++Cl-+HClO,下列叙述中正确的是( )
H++Cl-+HClO,下列叙述中正确的是( )
A.用pH试纸测得溶液pH<7
B.向其中加入AgNO3溶液,平衡向右移,溶液的pH变小
C.向其中加入NaOH使pH=7,所得溶液中微粒浓度的关系如下:c(Na+)>c(Cl-)>c(ClO-)=c(HClO)
D.若氯水久置pH会逐渐增大
查看答案和解析>>
科目: 来源: 题型:
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,A的质子数等于周期数,B与C的 P轨道均有三个成单电子,D的最高正价与最低负价代数和为4,E的最外层只有一个电子, 内层轨道处于全充满状态。试回答下列问题。
(1)基态E原子的电子排布式为_________;C和D的第一电离能较大的________(填元素符号)。
(2)DO32-中D原子的杂化类型为_________;A、D和氧元素组成的液态化合物A2DO4中存在的作用力有_____________。
(3)结构式为A—B=B—A的分子中σ键和π键的数目比为________;B2分子和NO+离子互为等离子体,则NO+的电子式为___________。
(4)向EDO4溶液中加入过量稀氨水,其化学方程式为_______________;产物中阳离子的配体是_____________(填化学式)。
(5)D(黑球)和E(白球)形成某种晶体的晶胞如图所示。已知该晶体的晶胞边长为516Pm,则黑球和白球之间最近距离为________pm(精确到0.1,已知![]() =1.732)若ED中D2-被O2-代替,形成的晶体只能采取NaCl型堆积,试从晶体结构分析其不同及原因__________。
=1.732)若ED中D2-被O2-代替,形成的晶体只能采取NaCl型堆积,试从晶体结构分析其不同及原因__________。

查看答案和解析>>
科目: 来源: 题型:
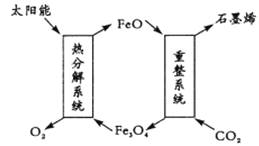
【题目】二氯化碳利用具有十分重要的意义,科学家有以下几个设想。
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如下:
①Fe3O4中Fe的化合价是+ 2和 __________;
②重整系统发生反应的化学方程式为______________________________。
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃。在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4 (g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右下图所示。
C2H4 (g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右下图所示。
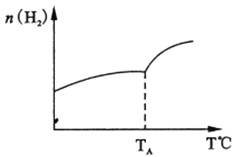
① 其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将_____________(填“增大”、“ 减小”或“不变”);
②△H________0(填“>”“<”“ 不能确定”)。
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4 ________ H2O (填“>”“<”“ 不能确定”)。
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3·H2O(aq) ![]() NH4+ (aq) +OH-(aq) △H1=a kJmol-1
NH4+ (aq) +OH-(aq) △H1=a kJmol-1
CO2 (g) + H2O(l)![]() H2CO3 (aq) △H2=bkJmol-1
H2CO3 (aq) △H2=bkJmol-1
H2CO3(aq) + OH-(aq)![]() HCO3-(aq) + H2O(l) △H3=ckJmol-1
HCO3-(aq) + H2O(l) △H3=ckJmol-1
则利用NH3 H2O吸收CO2制备NH4HCO3的热化学方程式为_____________________________;
②已知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5mol L-1 |
Ka1(H2CO3) | 4×10-7mol L-1 |
Ka2(H2CO3) | 4×10-11mol L-1 |
则反应NH4++HCO3-+H2O![]() NH3 H2O+ H2CO3的平衡常数k=___________。
NH3 H2O+ H2CO3的平衡常数k=___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】废旧无汞碱性锌锰电池可用于制造隐形战机的机身涂料MnxZn(1-x)Fe2O4,该电池工作反应原理为Zn+2MnO2+2H2O![]() 2MnO(OH)+Zn(OH)2。某化学小组利用废电池制涂料的工艺如下:
2MnO(OH)+Zn(OH)2。某化学小组利用废电池制涂料的工艺如下:
A.浸取:将去除表面塑料的旧电池加入水中浸取并过滤,滤液经操作a得KOH固体;
B.溶液:滤渣中加入过量稀硫酸和足量双氧水,至不再出现气泡时,过滤;
C.测成分:测步骤B中滤液成分,然后加入铁粉;
D.氧化:加入双氧水氧化;
E.调pH:滴加氨水调pH,经结晶处理得MnxZn(1-x)Fe2O4。
(1)浸取时的操作有 ______。
A.拆解、粉碎旧电池 B.降低温度 C.搅拌 D.加压
(2)操作a为________。
(3)溶渣时生成Mn2+的主要离子方程式为______________________________。
(4)若步骤C测得滤液中金属离子组成为:c(Mn2+) +c(Zn2+) =0.8mol/L, c(Fe2+ ) = 0. 1 mol/L。若滤液体积为lm3,要合成MnxZn(1-x)Fe2O4,需加入Fe粉质量为___________kg(忽略体积变化)。
(5)氧化时,因为分解所需双氧水的量比理论值大得多。其原因可能是①温度过高;②______。
(6)最后一步结晶时,处理不当易生成MnFe2O4和ZnFe2O4。要制得MnxZn(1-x)Fe2O4,最后一步结晶时需注意______________________。
(7)某小组构想用ZnSO4、MnSO4溶液为原料,以Fe作电极用电解法经过一系列步骤制得MnxZn(1-x)Fe2O4,则开始电解时阳极反应式为___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Na3N和NaH都是离子化合物,与水反应都有气体生成,下列说法中正确的是( )
A. 两种物质的阴离子半径都比阳离子半径小
B. 与水反应时,水都作氧化剂
C. 与盐酸反应都只生成一种盐
D. 溶于水,所得溶液都能使无色酚酞变红
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质在水中的电离方程式书写正确的是
A.NaOH===Na++O2-+H+ B.MgCl2===Mg2++Cl22-
C.KClO3===K++Cl-+3O2- D.NH4NO3===NH4++NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中均伴有颜色的变化,与其他颜色褪色原理不同的是( )
A.臭氧使有色布条褪色
B.SO2使品红溶液褪色
C.氯气使鲜花褪色
D.过氧化钠使品红溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,集气瓶内充满某混合气体,将集气瓶置于光亮处,然后挤压胶头滴管使胶头滴管内的水进入集气瓶,发现烧杯中的水会倒吸进入集气瓶,则集气瓶内的混合气体可能是

①CO、O2 ②NO、O2 ③NO2、O2④N2、H2 ( )
A. ①② B. ②④
C. ③④ D. ②③
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学活动小组设计以下装置进行不同的实验。

已知苯、溴苯的有关物理性质如下表:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(1)若小组同学欲用装置A、C制备溴苯,则A中反应的方程式____________, A处长导管的作用是冷凝回流,回流的主要物质有______________________(填化学式)实验结束后,向A中依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤,分液得粗溴苯,NaOH溶液洗涤的作用是____________;若进一步提纯粗产品,依次进行的实验操作名称是___________、__________。
(2)若小组同学欲在B 装置中用正丁醇、冰醋酸合成一种水果香精,则还需连接的装置是________(填序号),该装置中应加入试剂________。反应结束后,取下收集装置充分振荡后静置,分去水层,可得乙酸正丁酯粗产品。现要回收水层中的有机物,依次进行的实验操作名称及相关试剂为________、________、__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com