
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
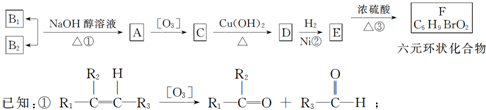
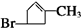

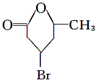

| 加热 |
| 加热 |
查看答案和解析>>
科目: 来源: 题型:阅读理解


| ||
| ||
 2SO3(g);△H=-196.6KJ?mol-1.平衡时容器内气体压强为起使时的90%.
2SO3(g);△H=-196.6KJ?mol-1.平衡时容器内气体压强为起使时的90%.查看答案和解析>>
科目: 来源: 题型:阅读理解
 已知:
已知:
| 有机物 | 密度/ g?cm-3 |
熔点/ ℃ |
沸点/ ℃ |
溶解性 |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com