
科目: 来源: 题型:
【题目】下列括号中的物质是除去杂质所需的药品,其中错误的是( )
A.NaCl溶液中有杂质Na2SO4(氯化钡)
B.FeSO4溶液中有杂质CuSO4(铁粉)
C.生石灰中混有少量石灰石(盐酸)
D.BaCl2溶液中有少量MgCl2(氢氧化钡)
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,NH3(g)、O2(g) NO(g)、H2O(g)的浓度比为4:5:4:6
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列除杂质的方法不正确的是( )
A.铜粉中混有铁粉:加入过量盐酸充分反应,过滤
B.CO2中混有HCl:将其通入NaOH溶液,洗气
C.NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体
D.FeCl2溶液中混有少量FeC13:加入Fe粉
查看答案和解析>>
科目: 来源: 题型:
【题目】将5molL﹣1的盐酸10mL稀释到200mL,从中取出5mL,这5mL溶液的物质的量浓度为( )
A.0.5 molL﹣1
B.0.25 molL﹣1
C.0.1 molL﹣1
D.1 molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】药物X、Y和高聚物Z,可以用烃A为主要原料,采用以下路线合成。
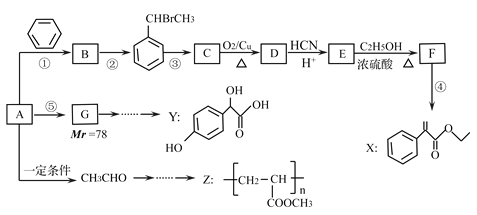
已知:Ⅰ.反应①、反应②的原子利用率均为100%.
Ⅱ. (R或R可以是烃基或氢原子)
(R或R可以是烃基或氢原子)
请回答下列问题:
(1)A的结构简式为____________。
(2)Z中的官能团名称为__________,反应③的条件为___________。
(3)关于药物Y(![]() )的说法正确的是______________。
)的说法正确的是______________。
A.1mol药物Y与足量的钠反应可以生成33.6L氢气。
B.药物Y的分子式为C8H8O4,能使酸性高锰酸钾溶液褪色
C.药物Y中⑥、⑦、⑧三个-OH的酸性由强到弱的顺序是⑧>⑥>⑦
D.1mol药物Y与H2、浓溴水中的Br2反应,最多消耗H2、Br2分别为4mol和2mol
(4)写出反应E→F的化学方程式_________________,F→X的化学方程式______________________。
(5)写出符合下列条件的E的一种同分异构体的结构简式____________。
①遇FeCl3溶液可以发生显色反应,且是苯的对位二元取代物;②能发生银镜反应和水解反应;③核磁共振氢谱有6个峰。
(6)参考上述流程以CH3CHO和CH3OH为起始原料,其它无机试剂任选,设计合成Z的线路。_________
查看答案和解析>>
科目: 来源: 题型:
【题目】炼锌厂的铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用。其流程图如下。已知FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。

金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
开始沉淀pH | 2.7 | 6.5 | 7.7 | 5.2 | 6.9 |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高浸出率可以采用的方法是(写出其中一点即可)______________。
(2)滤液I中有少量的AsO33-,若不除去,则AsO33-与Cd反应会产生一种有毒氢化物气体,该气体的分子式为_________。向滤液I中逐滴滴人酸性KmnO4溶液可与AsO33-发生反应生成FeAsO4,完成该反应的离子方程式:_________
___Fe2++___AsO33-+___MnO4-+ □= Mn2++ FeAsO4↓+ □,判断该滴定终点的现象是_______。
(3)流程中②调节pH时可以选用的试剂为________,滤渣Ⅱ的主要成份为________。
(4)常温下Zn(OH)2的溶度积Ksp=_____________________。
(5)制得的ZnSO4 7H2O需洗涤,洗涤晶体时应选用试剂为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】S2Cl2是一种重要的化工产品,常温时是一种有毒并有恶臭的金黄色液体,熔点-76℃,沸点138℃,易与水反应,进一步氯化可得SCl2。SCl2是樱桃红色液体,易挥发,熔点-122℃,沸点59℃。SCl2与S2Cl2相似,有毒并有恶臭,但更不稳定。S2Cl2可用下列装置制备。

请回答下列问题:
(1)写出S2Cl2的电子式_____________________;装置a中的试剂为________________。
(2)写出实验室制取Cl2的离子方程式___________________。
(3)装置b中的反应开始前,需进行的操作是_______________________。
(4)装置e的作用是______________________________ 。
(5)将d中获得的S2Cl2提纯,需要进行的操作是___________________。
(6) 若将S2Cl2放入水中同时产生沉淀和气体,写出S2Cl2与水反应的方程式______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:

(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
Ⅱ.(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示250C时NH3·H2O的电离常数Kb=_________________。用质量分数为17%,密度为0.93 g/cm3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=___________mL。
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_________,阴极的电极反应式是__________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2![]() 2Na2CO3+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中)。关于该电池,下列说法错误的是
2Na2CO3+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中)。关于该电池,下列说法错误的是

A. 充电时,Na+从阳极向阴极移动
B. 可以用乙醇代替TEGDME做有机溶剂
C. 放电时,当转移1mol电子负极质量减轻23g
D. 放电时,正极反应为3CO2 + 4Na++4e- = 2Na2CO3 + C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com