
科目: 来源: 题型:
【题目】下列叙述不正确的是
A. 盐析可提纯蛋白质并保持其生理活性
B. 油脂碱性或者酸性条件下的水解反应叫做皂化反应
C. 打针时用75%的乙醇溶液消毒是蛋白质变性知识的应用
D. 蛋白质、纤维素、淀粉都是高分子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
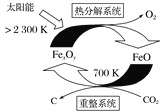
(1)科学家提出由CO2制取C的太阳能工艺如上图所示。
①若“重整系统”发生的反应中![]() =6,则FexOy的化学式为________。
=6,则FexOy的化学式为________。
②“热分解系统”中每分解1molFexOy,转移电子的物质的量为________。
⑵工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1
则2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g) ΔH3=________kJ·mol-1。
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是________(填字母)。
a. 逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的![]() 值变小
值变小
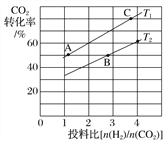
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如下图所示。T1温度下,将6molCO2和12molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=__________;KA、KB、KC三者之间的大小关系为____________。
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c(NH4+)________(填“>”、“<”或“=”)c(HCO![]() );反应NH
);反应NH![]() +HCO
+HCO![]() +H2ONH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
+H2ONH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
查看答案和解析>>
科目: 来源: 题型:
【题目】提纯下列物质(括号内为少量杂质),所选用的除杂试剂与分离方法正确是
不纯物质 | 除杂试剂 | 分离方法 | |
A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
C | 苯(Br2) | KOH溶液 | 分液 |
D | 苯(苯酚) | 浓溴水 | 过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关σ键和π键的说法错误的是
A. 在某些分子中,化学键可能只有σ键而没有π键
B. 分子中σ键的键能一定大于π键的键能
C. σ键的特征是轴对称,π键的特征是镜面对称
D. SO2形成π键与O3的π键是相似的
查看答案和解析>>
科目: 来源: 题型:
【题目】工业合成氨的反应:N2(g)+3H2(g) ![]() 2NH3(g)是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1mol H-H键、1mol N—H键、1mol N
2NH3(g)是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1mol H-H键、1mol N—H键、1mol N![]() N键放出的能量分别为436KJ、391KJ、946KJ。则:
N键放出的能量分别为436KJ、391KJ、946KJ。则:
(1)若1mol N2完全反应生成NH3可______(填“吸收”或“放出)热量_____KJ。
(2)如果将1mol N2 和 3mol H2混合,在一定条件下使其充分反应,反应放出的热量总小于上述数值,其原因是_____________________________________________________。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器中进行,反应经过10min后,生成10mol NH3,则用N2表示的化学反应速率是________mol·L -1·min-1。
(4)一定条件下,当成合成氨反应达到化学平衡时,下列说法正确的是(____)
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d. N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
查看答案和解析>>
科目: 来源: 题型:
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:![]()
已知:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ/mol
2NO(g)+O2(g)=2NO(g) △H=-116.2kJ/mol
则反应I的热化学方程式为________________。
(2)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) △H>0,请你分析该设想能否实现?______(填“是”或“否”) ,依据是_____________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka=1.70×10-4。
① 甲酸钠的水溶液呈碱性,请用离子反应方程式表示其原因___________。
② 向20mL 0.1mol/L的甲酸钠溶液中滴加10ml 0.1mol/L的盐酸,混合液呈______性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为______________。
(4)活性炭也可用于处理汽车尾气中的NO。在2L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:

①该反应的正反应为________(填”吸热”或“放热”)反应。
② 200℃时,平衡后向恒容容器中再充入0.1molNO,再次平衡后,NO的百分含量将_____。(填“增大”、“减小”或“不变”)。
③计算反应体系在335℃ 时的平衡常数_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )
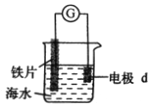
A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2+2H2O+4e ═ 4OH-
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H++2e ═ H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com