
科目: 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如下:
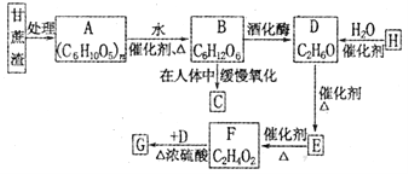
已知石油列解已成为生产H的重要方法,E的溶液能发生银镜反应,G是具有香味的液体,试填空。
(1)A的名称______;
(2)B的结构简式______;H的结构简式__________。
(3)写出H发生加聚反应的方程式:_____________。
(4)D→E的化学方程式:_____________。
(5)F→G的化学方程式:_____________。
(6)写出G的同分异构体中与CH3COOH互为同系物的结构简式:________`
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产、生活密切相关.下列叙述正确的是( )
A.我国古代四大发明之一黑火药由硫酸、硝酸和木炭按一定比例混合制成
B.PH计不能用于酸碱中和滴定终点的判断
C.石油的分馏,煤的干馏、气化、液化均是物理变化
D.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气
查看答案和解析>>
科目: 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103 mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
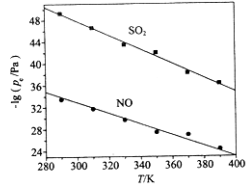
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ===SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=______。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ. 埃及人泽维尔用激光闪烁照相机拍摄到化学反应中化学键断裂和形成的过程,因而获得1999年诺贝尔化学奖。激光有很多用途,例如波长为10.3 微米的红外激光能切断B(CH3)3分子中的一个B-C键,使之与HBr发生取代反应:B(CH3)3+HBr![]() B(CH3)2Br+CH4
B(CH3)2Br+CH4
而利用9.6微米的红外激光却能切断两个B-C键,并与HBr发生二元取代反应。
(1)试写出B(CH3)3与HBr二元取代的化学方程式:___________________
(2)利用5.6 g B(CH3)3和9.72 g HBr正好完全反应,则生成物中甲烷的物质的量为____。其他两种产物的物质的量之比为___________。
Ⅱ.橡胶可用于制造汽车内胎,合成丁基橡胶的一种单体A的分子式为C4H8,A氢化后得到2甲基丙烷。完成下列填空:
(1)A可以聚合,写出A的两种聚合方式(以化学方程式表示):____________________。
(2)A与某烷发生反应生成分子式为C8H18的物质B,B的一卤代物只有4种,且碳链不对称。写出B的结构简式_______________。
(3)写出将A通入下列两种溶液后出现的现象。
A通入溴水:______________;A通入溴的四氯化碳溶液:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用系统命名法命名CH3CH(CH3)CH=CH2 ___________________。
(2)“金刚烷”,它可以看做是由四个等同的六元环组成的空间构型。
![]()
请判断:
①一溴代物有________种。
②由氯原子取代金刚烷亚甲基(—CH2—)上的氢原子所形成的二氯代物共有_________种。
(3)写出分子式为C4H6,且能使溴水因发生反应而褪色的链烃的结构简式:____________、____________、____________
(4)某有机物,它的相对分子质量为88。将8.8g该含氧有机物充分燃烧后的产物通过浓硫酸后增重7.2g,再通过足量的澄清石灰水后,有40g白色沉淀生成。求:
① 该含氧有机物的分子式_______________;
② 该含氧有机物有多种同分异构体,写出其中能水解的同分异构体的结构简式___________、____________、___________、__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.用化学用语回答下列问题:
(1)写出二氧化碳分子的电子式:___________;
(2)写出氮气分子的结构式___________。
Ⅱ.下列物质:① N2 ② CO2 ③ NH3 ④ Na2O ⑤Na2O2 ⑥ NaOH ⑦ CaBr2 ⑧ H2O2 ⑨ NH4Cl ⑩ HBr。
(1)含有极性键和非极性键的是_______;
(2)含有非极性键的离子化合物是_____。(填序号,下同)
Ⅲ.下列变化中:① 干冰气化; ② 硝酸钾熔化; ③ KHSO4熔融; ④ 硫酸溶于水;
⑤ 蔗糖溶于水;⑥ HI分解; ⑦ 碘升华; ⑧ 溴蒸气被木炭吸附。
(1)未破坏化学键的是_____;
(2)仅离子键被破坏的是____;
(3)仅共价键被破坏的是____。
Ⅳ.下列物质:① 1H、2H、3H ; ② H2O、D2O、T2O; ③ O2、O3; ④ 14N、14C
(1)互为同位素的是:______;
(2)互为同素异形体的是:______;
(3)氢的三种原子1H、2H、3H 与氯的两种原子35Cl、37Cl相互结合为氯化氢,可得分子中相对分子质量不同的有________种。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家对一碳化学进行了广泛深人的研究并取得了一些重要成果。
(1)已知:CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.1kJ/mol;
CH3OH(g) △H1=-90.1kJ/mol;
3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CO与H2合成CH3CH=CH2的热化学方程式为________。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2mo1H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。

①5min时三个容器中的反应达到化学平衡状态的是容器_______(填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______。
③当三个容器中的反应均达到平衡状态时,CO的转化率最高的是容器___________。(填序号,下同);平衡常数最小的是容器_____________。
(3)CO常用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中![]() 与温度(T)的关系如图2所示。下列说法正确的是_____(填字母)。
与温度(T)的关系如图2所示。下列说法正确的是_____(填字母)。

a.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
b.CO用于工业冶炼金属铬(Cr)时,还原效率不高
c.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
d.CO还原PbO2的反应△H>0
(4)工业废水中含有甲醛,该厂降解甲醛的反应机理如图3所示,则X表示的粒子是_____,总反应的化学方程式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一小块钠投入盛有5mL饱和CuSO4溶液的试管里,不可能观察到的现象是( )
A.钠熔成小球并在液面上游动 B.有气体生成
C.试管底部有红色物质生成 D.溶液变浑浊
查看答案和解析>>
科目: 来源: 题型:
【题目】(2016天津)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com