
科目: 来源: 题型:
【题目】某有机物分子式为C5H10O,它能发生银镜反应,若将它与H2加成,所得产物的结构简式可能是
A.( CH3)3CCH2OH B.CH3CH2CH(OH)CH2CH3
C.CH3CH(OH)CH2CH2CH3 D.CH3CH2C(CH3)2OH
查看答案和解析>>
科目: 来源: 题型:
【题目】通常人们把拆开1mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。
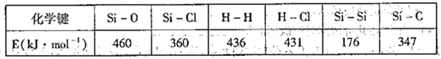
工业上高纯硅可通过下列反制取:SiCl4(g) +2H2(g)= Si(g) +4HCl(g),(已知 lmol晶体Si中2molSi -Si键),该反应产生的热量为
A. 吸收45kJ mo1-1 B. 放出412 kJ mo1-1
C. 吸收 236 kJ mo1-1 D. 放出236 kJ mo1-1
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)红细胞中血红素结构如图所示,回答下列问题:

①Fe2+的轨道表示式[Ar]________。
②所含短周期元素电负性从大到小的顺序是___________。
③羧基中碳原子的杂化轨道方式是______________。
④在肺部,血红素中的Fe2+结合的水分子与氧分子交换,形成氧合血红蛋白,经动脉运送到组织释放出O2;然后血红素结合组织代谢所产生的CO2,经静脉送回肺中与水分子交换,最后将CO2排出体外,完成呼吸过程。血红素中Fe2+与CO2中____原子以____形式结合,这种结合是可逆的,比Fe2+与N的结合弱的原因是______________。
(2)磁性氧化铁Fe3O4含有Fe2+和Fe3+,其晶体属于立方晶系,氧原子呈面心立方密堆积,Fe3+和一半的Fe3+随机占据八面体空穴,电子可在Fe2+、Fe3+间迅速发生转移,另一半Fe3+作阳离占据四面体空穴。Fe3O4是一种盐,其真实结构可较好地表示为_________[Fe2+和Fe3+分别用Fe(II)、Fe(III)表示];该晶体_____导电(填“能”、“不能”);该晶体的密度为5.18g·cm-3,其晶胞中最近的两个氧原子之间的核间距_________cm(列出计算式,不必计算最终结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】1 molX气体跟amolY气体在体积可变的密闲容器中发生如下反应X( g) +aY(g)=bZ(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A. a = 2,b = 1 B. a=39,b =2 C. a=2,b = 2 D. a=3,b = 3
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。工业上用粗氧化铜(含Fe2O3、FeO、Cu2O以及少量不溶性杂质)为原料制取氯化铜晶体 (CuCl2·2H2O)的为生产流程如下:

己知:Cu2O在酸性环境中可以生成Cu2+和Cu 回答下列问题:
(1)己知“浸渣”中不含铜单质,写出Cu2O在“盐酸浸出”中发生反应的化学方程式:___________________________________________
(2)“盐酸浸出”中,铜的浸出率与浸出时间的关系如下图所示。由图可得出如下变化规律:

①____________________________
②______________________________。
(3)“净化除杂”需先加入C1O2,其作用是(用离子方程式表示)______________。
然后再调节溶液的pH约为4,可选用的试剂是(填选项字母)______________。
A. CuSO4 B.CuO C.Cu2(OH)2CO3 D.NH3·H2O
(4)“操作I”包含多步实验基本操作,依次是__________、洗涤和风干等。工业上常采用无水乙醇代替水进行洗涤的主要原因是______________。
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,称取ag晶体,加入足量10%的氢氧化钠溶液,过滤、洗涤后,用酒精灯加热至质量不再减轻为止,冷却、称量所得固体质量为bg。计算得x= ______________。(用含a、b的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】油画变黑,可用一定浓度的H2O2溶液擦洗修复,发生的反应为 4H2O2+PbS→PbSO4+4H2O下列说法正确的是
A. H2O 是氧化产物 B. H2O2 中负一价的氧元素被还原
C. PbS 是氧化剂 D. H2O2在该反应中体现还原性
查看答案和解析>>
科目: 来源: 题型:
【题目】已知 25℃下时,NH3·H2O kb=1.77×10-5;H2CO3 ka1=4.30×10-7、ka2=5.61×10-11。 25℃时有关NH4HCO3溶液的说法中正确的是
A. 呈弱酸性
B. c(OH-)+c(NH3·H2O)=c(H+)+c(H2CO3)
C. 滴入NaOH 溶液发生反应:NH4++OH-=NH3·H2O和HCO3-+OH-=H2O+CO32-
D. 滴入NaOH溶液,则![]() 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)工业上可在碱性溶液中通过电解的方法实现由N2制取NH3:
2N2+6H2O![]() 4NH3+3O2通入N2的一极是______(填“阴极”或“阳极”)阳极的电极反应式是_________________。
4NH3+3O2通入N2的一极是______(填“阴极”或“阳极”)阳极的电极反应式是_________________。
(2)有人设想寻求合适的催化剂和电极材料.以N2,H2为电极反应物;以HCl-NH4Cl为电解质榕液制取新型燃料电池。请写出该电池的正极反应式________________。
(3)电解原理在化学工业中有着广泛的应用。若用惰性电极电解含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生的气体672mL(标准状况下)时,溶液的c(H+)=_____(假设电解后溶液体积不变)。
(4)铁、铝是现代金属材料的主角。
已知铝的燃烧热为1675kJ/mol,2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-822kJ/mol;
则2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) △H=________;
查看答案和解析>>
科目: 来源: 题型:
【题目】在C(s)+CO2(g) 2CO(g)的反应中,现采取下列措施:①缩小体积,增大压强 ②增加碳的量 ③恒容充入CO2 ④恒容下充入N2 ⑤ 恒压下充入N2。能够使反应速率增大的措施是( )
A. ①④B. ②③⑤C. ①③D. ①②④
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z分别为原子序数递增的短周期元素,X、Y的阳离子与Ne具有相同的电子层结构, 且其单质均可与冷水反应,生成W的单质;Z的单质为黄绿色气体。下列说法正确的是
A. W与X形成的简单二元化合物的电子式为![]()
B. 短周期元素中Y的原子半径最大
C. 工业上通过电解Y的氧化物制取Y的单质
D. 最外层电子数等于其电子层数的金属与Z形成离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com