
科目: 来源: 题型:
【题目】下列有关组成生物体的化学元素的说法,正确的是
A. 马铃薯植株缺K,将会造成其产量下降
B. Mg是叶绿体中各种色素分子必不可少的组成元素
C. Cu参与组成的血红蛋白
D. P是组成磷脂、ATP、NADPH及核糖等多种化合物的组成元素
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
![]()
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 含T的盐溶液一定显酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】药物Targretin(F)能治疗顽固性皮肤T-细胞淋巴瘤,其合成路饯如下图所示:
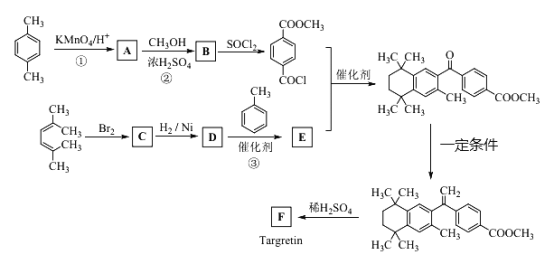
已知:①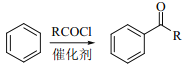
②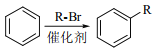
③![]() (R表示烃基或芳基)
(R表示烃基或芳基)
(1)反应①的反应类型是______________________
(2)反应②的化学方程式_________________________________________。
(3)C的结构简式是_____________________________________________。
(4)反应③的化学方程式____________________________________________。
(5)F的分子式C24H28O2,F中含有的官能团____________________________。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑-O-O-或![]() 结构)________________________________。
结构)________________________________。
a.苯环上的一氯代物有两种 b.既发生银镜反应又能发生水解反应
(7)已知: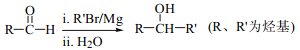 ,以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
,以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成![]() ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_________________________
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是
A. 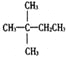 B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸酸化可以制备草酸(H2C2O4),装置如图所示:
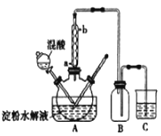
实验过程如下:
①将1:1的淀粉水乳液与少许98%硫酸加入烧杯中,水浴加热30 min;
②将一定量的淀粉水解液加入三颈烧瓶中;
③在5560℃条件下,缓慢滴加混酸(65%HNO3与98%H2S04的质量比为4 : 3)溶液;
④反应3h左右,冷却、过滤后再重结晶得二水合草酸晶体(H2C2O4·2H2O)。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3=3H2C2O4+9NO2↑+3NO↑+9 H2O
C6H12O6+8HNO3=6CO2↑+8NO↑+10H2O
C6H12O6+2HNO3=6CO2↑+2NO↑+4H2O
请回答下列问题:
(1)实硷①加入98%硫酸少许的目的是_____________。
(2)检验淀粉是否水解完全所用的试剂为____________。
(3)冷凝水的进口是_______(填“a”或“b”)。
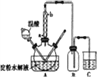
(4)装置B的作用为___________。
(5)实验中若混酸滴加过快,将导致草酸产量下降,其原因是______________。
(6)当尾气中n(NO2) :n(NO)=1:1时,过量的NaOH溶液能将氮氧化物全部吸收,只生成一种钠盐,化学方程式为__________。若用步驟④后含硫酸的母液来吸牧氮氧化物,其优点是_____,缺点是________。
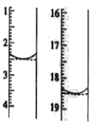
(7)二水合草酸晶体纯度的测定。称取该晶体0.12g,加水溶解,用0.020 mol L-1的酸性KMnO4溶液滴定(杂质不参与反应),该反应的离子方程式为 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O。此时溶液颜色由_____变为_____。滴定前后液面读数如图所示,则该晶体中二水合草酸的质量分数为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I .氯及其化合抝在生活中应用广泛。
(1)指出氯元素在周期表中的位置_____________。
(2)净水丸能对饮用水进行快速的杀菌消毒,外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等) 除去。
① 优氯净中氯元素的化合价为___________。
② 亚硫酸钠将水中多余次氯酸除去的离子方程式为___________________。
II.某无机盐M是一种优良的氧化剂,为确定其化学式,设计如下探究实验:

已知:
①无机盐M仅由钾离子和一种含氧酸根组成,其分子中的原子个数比为2:1:4;
②该小组同学将溶液N分为二等份,分别按路线I、路线II进行实验。每步部反应完全。
请按要求回答下列问题:
(1)由路线I的现象可知,溶液N中含有的阳离子是_________。
(2)由实验流程图可推得.含氧酸盐W的化学式是_______;由路线II可知,1.98g无机盐M中所含钾元素的质量为_______g。
(3)无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为 _______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 molL-1s-1;反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。则T 100℃(填“大于”“小于”),判断理由是 。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)少量CO的存在会引起生产中催化剂中毒,常用SO2氧化CO,本身被还原为S。
已知:① Cc(s)+ 1/2O2 (g)=CO (g) △H1=-l26.4kJ·mol-1
②③C(s)+O2 (g) =CO2 (g) △H2=-393.5kJ·mol-1
@S(s)+O2 (g)=SO2 (g) △H3=-296.8kJ·mol-1
则SO2氧化CO的热化学反应方程式__________________。
(2) CO可用于合成甲醇,反应方程式CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
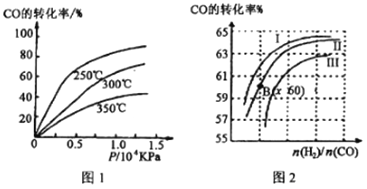
① CO转化率与温度、压强的关系如图所示,该反应△H_______0 (填“>”或“<”)
图2中曲线I、II、III对应的平衡常数分别为K1、K2、K3,则它们的大小关系为___________。测得B(x,60)点氢气的转化率为40%,则x=___________。
②一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,达到平衡时,CO与H2体积之比为2:1,则平衡常数K=___________。
(3)处理高浓度乙醛废水的原理:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:
CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:
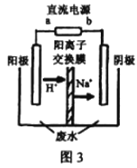
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别:4OH- -4e-=O2↑+2H2O;__________________。
②在实际处现过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入lm3乙醛的含量为300mg L-1的废水,可得到乙醇_______ kg(结果保留2位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的结构简式如图,下列说法正确的是( )
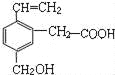
A. 该有机物的分子式为C11H15O3
B. 该有机物不能发生取代反应
C. 1 mol该物质与足量的钠反应可以生成1 mol氢气
D. 1 mol该有机物可以与1 mol碳酸钠发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com