
科目: 来源: 题型:
【题目】按要求完成下列问题:
(1)在①苯 ②乙醇③甲苯 ④氯乙烷 ⑤![]() ⑥
⑥ ⑦
⑦![]() 七种物质中(填编号)
七种物质中(填编号)
能和金属钠反应放出H2的有_________________常温能与NaOH溶液反应的有___________
常温下能与溴水反应的有____________________能使酸性KMnO4溶液褪色的有__________
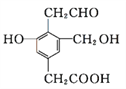
(2)某有机物结构简式如图所示,则用足量的Na、NaOH、NaHCO3、浓溴水分别与等物质的量的该有机物反应时,消耗Na、NaOH、NaHCO3和Br2的物质的量之比为__________.
(3)A、B、C 三种醇同足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为2:6:3,则A、B、C 三种醇分子中含羟基数目之比是______________
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合径中乙炔的体积分数为( )
A.12.5% B.25% C.50% D.75%
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是部分金属和非金属材料发现和使用的时间简轴。请回答:
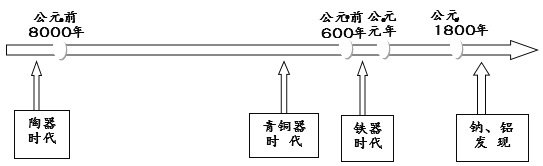
(1)我国最早使用的合金是_________;
(2)Cu、Fe、Na、Al四种金属元素中,金属性最强的是_______(填元素符号);
Al的原子结构示意图是________________________;
(3)我国西汉时期就开始冶炼铜,古人有“曾青得铁则化为铜”的记载,是现代“湿法炼铜”的先驱,请写出上述反应的化学方程式:____________________________;
(4)19世纪初,钠和铝的发现得益于电解技术的应用。
冶炼铝的原料Al2O3属于_____氧化物(选填“酸性”、“碱性”或“两性”);冶炼铝的反应为:2 Al2O3(熔融)![]() 4Al +3O2↑ ,反应中生成1molAl转移电子_________mol。
4Al +3O2↑ ,反应中生成1molAl转移电子_________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中,有关试剂的保存方法错误的是
A. 液溴用水封保存 B. 少量金属钠保存在煤油中
C. 烧碱溶液保存在带玻璃塞的试剂瓶中 D. 浓硝酸保存在棕色细口瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向盛有60mL pH=4 HA溶液的绝热容器中加入pH=13的NaOH溶液,所得混合溶液的温度(T)与加入NaOH溶液体积(V)的关系如图所示。下列叙述不正确的是

A. HA溶液的物质的量浓度为0.067mol·L-1
B. 25℃时,HA的电离平衡常数约为1.5×10-9
C. a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D. b点时:c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】甲同学进行了FeCl2溶液的配制、浓度的测定以及Fe2+还原性的实验,并针对异常现象进行探究。
步骤一:制取FeCl2甲同学准备用两种方案制取。
方案1:按下图装置用H2还原无水FeCl3制取。
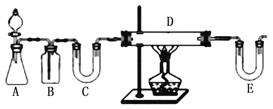
E中盛放的试剂是____________;D中反应的化学方程式为____________。此方案有个明显的缺陷是___________________________。
方案2:由0.1 molL-1 FeCl3溶液制取FeCl2溶液,你认为其操作应该是____________ 。
步骤二:测定方案2所配FeCl2溶液的物质的量浓度。用重铬酸钾法(一种氧化还原滴定法)可达到目的。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液480 mL,实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少_______________,
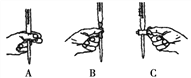
本实验滴定过程中操作滴定管的图示正确的是____________(填编号)。
下列错误的操作使测定的FeCl2 溶液浓度偏小的是______________。
A.若在配制K2Cr2O7标准溶液定容时采取俯视姿势
B.若滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失。
C.锥形瓶洗净后未干燥
步骤三:向2 mL FeCl2溶液中滴加2滴0.1 mol·L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol·L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
甲同学探究“步骤三”中溶液褪色的原因:
实验I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
实验II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀,并测得生成了两种可直接排放到空气中的气体。
实验III.向2 mL 0.1 mol·L-1 FeCl3溶液中滴加2滴0.1 molL-1 KSCN溶液,变红,通入O2,无明显变化。
①实验I说明溶液红色褪去是因为SCN-发生了反应而不是Fe3+发生反应。
②实验III的目的是_____________________。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-和相关气体。写出该反应的离子方程式_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com