
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:①称取过氧化钠固体2.00g;②把这些过氧化钠固体放入气密性良好的气体发生装置中;③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在112mL处恰好与水槽内液面相平;④将烧瓶中的液体转移到250mL的容量瓶中,洗涤并将洗涤液也转入容量瓶,然后加入蒸馏水,定容,使液面恰好与刻度相切;⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4溶液去滴定,至终点时用去了24.20mLKMnO4溶液(此时锰全部以Mn2+存在)
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:①称取过氧化钠固体2.00g;②把这些过氧化钠固体放入气密性良好的气体发生装置中;③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在112mL处恰好与水槽内液面相平;④将烧瓶中的液体转移到250mL的容量瓶中,洗涤并将洗涤液也转入容量瓶,然后加入蒸馏水,定容,使液面恰好与刻度相切;⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4溶液去滴定,至终点时用去了24.20mLKMnO4溶液(此时锰全部以Mn2+存在)查看答案和解析>>
科目: 来源: 题型:
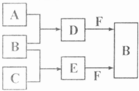 A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).试回答:
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).试回答:



查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com