
科目: 来源: 题型:
【题目】卤族元素在生活中有广泛应用,根据所需知识回答下列问题。
(1)氟元素基态原子的价电子排布图:_________,卤族元素位于元素周期表______区。
(2)在一定浓度的氢氟酸溶液中,部分溶质以二分子缔合(HF)2形式存在,使HF分子缔合的作用力是_______________。
(3)BF3常温下是气体,有强烈的接受弧电子对的倾向。BF3分子的立体构型为______,固态时的晶体类型是_______,BF3与NH3相遇立即生成白色固体,写出该白色固体物质的结构式并标注出其中的配位键_____。
(4)根据下表提供的数据判断,熔点最高、硬度最大的是_______(填化学式)。
离子晶体 | NaF | MgF2 | AlF3 |
晶格能(KJ·mol-1) | 923 | 2957 | 5492 |
(5)已知NaClO2晶体中阴离子为V型,ClO2-中氯原子的弧电子对数是______,ClO2-中氯原子的杂化轨道类型为_____,HClO4比HClO2酸性强的原因是_______。
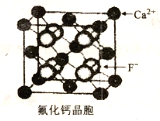
(6)CaF2晶胞如下图所示。已知:NA为阿伏伽德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的密度可表示为_____g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠是重要漂白剂,大庆市某高中化学实验探究小组设计如下实验制备亚氯酸钠(NaClO2)晶体。
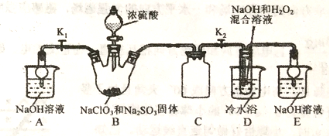
【查阅资料】
I.NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成 NaClO3和NaCl。
II.B中发生的主要反应:2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O。
【进行实验】
(1)盛装NaClO3和Na2SO3固体的仪器名称是_____。
(2)装置C的作用是____________。
(3)ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为______。
(4)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作。
①55℃蒸发结晶;②趁热过滤;③38-60℃热水洗涤;④低于____干燥,得到成品。
右图是某同学的过滤操作示意图,其操作不规范的是________(填标号)。
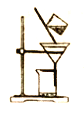
a.将滤纸湿润,使其紧贴漏斗壁
b.滤纸边缘高出漏斗边缘
c.用玻璃棒引流
d.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
【实验反思】
(1)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_______。
(2)实验须使B中NaClO3稍微过量,原因是__________,如NaClO3不足,则装置D中可能产生SO42-,检验装置D中是否含有SO42-的方法是:取少量D中反应后的溶液于试管中,__________,证明溶液中存在SO42-。
(3)测定产品中NaClO2的纯度。测定时进行如下实验:
准确称mg样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用cmol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。所称取的样品中NaClO2<span lang="EN-US" style="font-size:10.5pt;mso-bidi-font-size:12.0pt;font-family:"Times New Roman","serif";mso-fareast-font-family:"Times New Roman";mso-ansi-language:EN-US;mso-fareast-language:ZH-CN;mso-bidi-language:AR-SA">质量百分含量</span>为_________(用含m、c、V的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A. 铵盐不稳定,受热分解都产生氨气
B. N2是空气中的主要成分之一,雷雨时可直接转化为NO2
C. 由于浓硫酸有强氧化性,因此不能用铁罐贮存浓硫酸
D. 浓硝酸不稳定,实验室保存在棕色试剂瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,Ka(CH3COOH)=1.8×10-5、Ka(HClO)=3.0×10-8、Ksp(AgCl)=4.0×10-10、Ksp(AgBr)=5.0×10-13。下列说法正确的是
A. 由电离常数分析,CH3COOH溶液的pH一定比HClO溶液的pH小
B. 物质的量浓度相等的CH3COONa和NaClO混合溶液中,各离子浓度大小关系为:
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH)>c(H+)
C. 25℃时,反应AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K=800
AgBr(s)+Cl-(aq)的平衡常数K=800
D. 物质的量浓度相等的NaClO溶液和CH3COONa溶液相比较,两者离子的总浓度相等
查看答案和解析>>
科目: 来源: 题型:
【题目】采用电解法还原CO2是CO2资源化的一种方法。某学习小组设计了一套以CO2为原料制备ZnC2O4的装置,其反应原理示意图如下(电解液不参与电极反应)。下列说法正确的是

A. 电源的正极应与Pb电极连接
B. 电解时Zn2+可通过阳离子交换膜进入左侧
C. 电解时,阴极反应为:Zn-2e-═Zn2+
D. 标况下,消耗CO2气体4.48L时,交换膜右侧电解液质量减轻6.5g
查看答案和解析>>
科目: 来源: 题型:
【题目】镇痉药物C、化合物N以及高分子树脂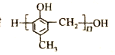 的合成路线如下:
的合成路线如下:

(1)A的化学名称为_____,A在催化剂作用下可与H2反应生成B,B的式量为108,B的结构简式为_____。
(2)C中官能团的名称为_____,C在碱性条件下水解的化学反应方程式为_____。
(3)A与银氨溶液反应的化学方程式为_________。
(4)F与甲醛合成高分子树脂的反应类型为_________,N的结构简式为________。
(5)扁桃酸的一种同分异构体满足下列条件:
①遇FeCl3溶液不发生显色反应
②能发生银镜反应,在酸性条件下水解产物之一能与FeCl3溶液发生显色反应
③分子中有5种不同化学环境的氢,核磁共振氢谱峰面积之比为:1:2:2:1.
写出该同分异构体的结构简式________。
(6)写出用乙醇为原料制备化合物CH3COCl的合成路线_________。
合成路线流程图示例如下:
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】一种碳纳米管新型二次电池的装置如图所示。下列说法中正确的是
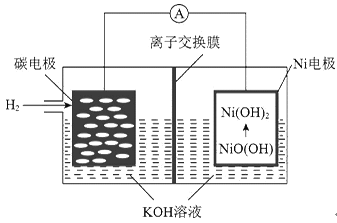
A. 离子交换膜选用阳离子交换膜(只允许阳离子通过) B. 正极的电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
C. 导线中通过1mol电子时,理论上负极区溶液质量增加1g D. 充电时,碳电极与电源的正极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com