
科目: 来源: 题型:
【题目】镁、铁组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48 L,下列推断中错误的是
A. 参加反应的镁、铁共0.2 mol
B. 参加反应的盐酸为0.2 mol
C. 镁、铁在反应中共失去电子0.4 mol
D. 若与足量的稀硫酸反应能产生氢气0.2 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~6 min的平均反应速率:v(H2O2)≈ 3.3×10﹣2 mol/(Lmin)
B. 6~10 min的平均反应速率:v(H2O2)< 3.3×10﹣2 mol/(Lmin)
C. 反应到6 min时,H2O2分解了50%
D. 反应到6 min时,c(H2O2)=0.30 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组的同学们对SO2的有关反应进行实验探究:
【实验I】探究SO2催化氧化的反应:

(1)装置 A模拟工业生产中SO2催化氧化的反应,其化学方程式是_________________________。〇
(2)为检验反应后的气体成分,将上图装置依次连接的合理顺序为A、(按气流方向,用字母表示)_______。
(3)能证明气体中有SO2的实验现象是_____________,有SO3的实验现象是_____________。
【实验II】探究SO2与Fe(NO3)3,溶液的反应:

(4)X中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,再关闭弹簧夹,目的是 ___________________________。
(5)装置Y中产生了白色沉淀,其成分是_________;该研究小组对产生白色沉淀的原因进行了假设:
假设1:在酸性条件下SO2与NO3-反应;
假设2:SO2与Fe3+反应;
假设3:___________________________。
(6)某同学设计实验验证假设1,请帮他完成下表中内容。
实验步骤 | 现象和结论 |
①测定Y中混合溶液的pH; ②配制与步骤①有相同pH的________,并通入适量N2; ③将SO2通入步骤②中溶液。 | 若出现白色沉淀则假设1成立,若不出现白色沉淀则假设1不成立。 |
经验证假设1成立,则验证过程中发生反应的离子方程式是_______________(提示:此条件下未见气体产生)。
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温下,在体积恒定的密闭容器中发生可逆反应:2SO2 (g)+ O2(g) ![]() 2SO3(g),下列不能用来判断该反应达到平衡状态的是
2SO3(g),下列不能用来判断该反应达到平衡状态的是
A. 容器中压强不再变化 B. SO2的体积分数不再变化
C. 容器中混合物的密度不再变化 D. 容器中各物质的浓度不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)①氯胺(NH2Cl)的电子式为_______。
②工业上可利用Cl2和NH3反应制备氯胺,该反应的化学方程式为_______。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol·L-1 NaOH溶液充分反应放出的热量如下表所示:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | x |
2 | 1.0 | 2.00 | y |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为__________。
(3)用焦炭还原NO的反应为:2NO(g) + C(s) ![]() N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
②该反应的ΔH___0 (填“>”或“<”)。
③丙容器达到平衡时,NO的转化率为___________。
(4)常温下,在NH4HCO3溶液中,c(NH4+)________c(HCO3-) (填“>”、“<”或“=”);反应NH4++HCO3-+H2O ![]() NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
查看答案和解析>>
科目: 来源: 题型:
【题目】肉桂酸异戊酯G(![]() )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:
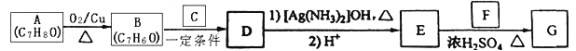
已知以下信息:
①![]()
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。回答下列问题:
(1)A的化学名称为____________;
(2)D与上述的条件 1)反应的化学方程式为__________________________________________ ;
(3)F中含有官能团的名称为____________ ;
(4)E和F反应生成G的化学方程式为__________________________________________________,反应类型为____________;
(5)F的同分异构体中不能与金属钠反应生成氢气的共有________ 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】据报导,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS—Na(对氨基水杨酸钠)也是其中一种。它与雷米封可同时服用,可以产生协同作用。已知:
①![]() (苯胺、弱碱性、易氧化)
(苯胺、弱碱性、易氧化)
②![]()
下面是PAS—Na的一种合成路线(部分反应的条件未注明):

按要求回答问题:
(写)出下列反应的化学方程式并配平
A→B:_______________________;
B→C7H6BrNO2:______________________;
(2)出下列物质的结构简式:C:____________________
D:______________________;
(3)出反应类型:II_______________,
(4)D→ E (反应III)所需条件_____________;
(5)写出C到D的化学反应方程式:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 1mol Na被完全氧化生成Na2O2,失去2NA个电子
B. 0.5mol锌粒与足量的盐酸反应产生H2为11.2L
C. 电解58.5g熔融的氯化钠,能产生23.0g金属钠、22.4L氯气(标准状况)
D. 标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com