
科目: 来源: 题型:
【题目】苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氧法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
![]()
(1)若升高温度,该反应的平衡常数变大,则ΔH____________(填“大于0”或“小于0”)。该反应在_______________条件下能自发进行(填“较高温度”、“较低温度”或“任何温度”)。
(2)维持体系总压强ρ恒定,在温度T时,物质的量为2mol、体积为1L的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为80%,则在该温度下反应的平衡常数K=_____。
(3)在体积为2L的恒温密闭容器中通入2mol乙苯蒸汽,2分钟后达到平衡,测得氢气的浓度是0.5mol/L,则乙苯蒸汽的反应速率为_________________;维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,则v正_______v逆(填“大于”、“小于”或“等于”)
(4)工业上,通常在乙苯蒸汽中掺混水蒸气(原料中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
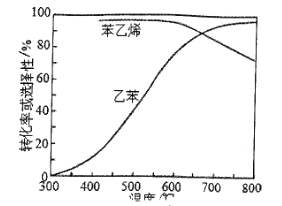
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实_________________________。
②控制反应温度为600℃的理由是_____________________。
(5)某燃料电池以乙苯为燃料,Li2CO3与K2CO3混合的碳酸盐为电解质的高温型燃料电池,其负极的电极反应式为_____________________,正极上通入的气体为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
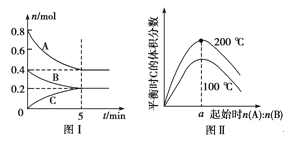
A.图Ⅱ所知反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
B.200 ℃时,反应从开始到平衡的平均速率v(B)=0.02 mol·L-1·min-1
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He的瞬间,v正>v逆
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数等于0.5
查看答案和解析>>
科目: 来源: 题型:
【题目】锑白(Sb2O3)在工业中有着广泛的作用。用辉锑矿(主要成分为Sb2S3,还含有少量SiO2)制备锑白的两种工艺如下:
I.火法制取锑白,是将辉锑矿装入氧化炉的坩埚中,高温使其熔化后通入空气,充分反应后,经冷却生成锑白。写出火法制取锑白的化学方程式:________________________________________。
Ⅱ. 湿法制取锑白的工艺流程如图:

已知:
①Sb3+与Fe2+的氧化性强弱相当
②常温下:
化合物 | Fe(OH)2 | Fe(OH)3 | Sb(OH)3 |
Ksp近似值 | 8×10-16 | 4×10-26 | 4×10-42 |
③Sb2O3为白色粉末,不溶于水,溶于酸和强碱。
④水解时保持溶液的c(H+)=0.1~0.3mol/L
(1)浸出是将辉锑矿溶于FeCl3溶液,请写出其中发生的氧化还原反应离子方程式_____________________________________________。滤渣的成分为______________________。
(2)采用铁粉作为还原剂进行还原,其目的是除去溶液中的离子___________(填离子符号),还原反应结束后,可用______________溶液来检验还原是否彻底。
(3)SbCl2是无色晶体,100升华,分子中所有原子都达到8e-稳定结构,请写出SbCl2的电子式____________________。
水解是利用SbCl2的水解反应制取Sb2O3(SbCl2的水解分为多步),其反应可以简单表示为:
SbCl3+3H2O![]() Sb(OH)2+3HCl,2Sb(OH)2=Sb2O3+3H2O
Sb(OH)2+3HCl,2Sb(OH)2=Sb2O3+3H2O
为了促进水解趋于完全,可采取的措施(填两点):_____________________
(4)简述检验沉淀是否洗净的实验方法:__________________________________________。
(5)若不加铁还原,则最终所得锑白的产率将_____________________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,向200mL 0.1 molL-1CH3COONa溶液中,逐渐加入0.1 molL-1盐酸(不考虑挥发),CH3COOH、CH3COO-物质的量随加入盐酸体积的变化关系如图所示,下列说法正确的是

A. 随着盐酸加入,溶液中水的电离程度逐渐增大。
B. 随着盐酸加入,  逐渐增大。
逐渐增大。
C. M 点,n(H+)-n(OH-)=(a×10-4-0.01)mol
D. 当 V(盐酸)=200mL时,c(CH3COO-)+c(CH3COOH)>c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的用途说法错误的是 ( )
A. 甲醛的水溶液(福尔马林)可用于防腐 B. 乙二醇可用于配制汽车防冻液
C. 部分卤代烃可用作灭火剂 D. 酚类化合物有毒,不能用于杀菌消毒
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列图像的叙述,正确的是

A. 图甲表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH 的变化
B. 图乙表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH: a>b
C. 图丙表示A、B两物质的溶解度随温度变化情况,将A、B 饱和溶液分别由t1℃升温至t2℃ 时,溶质的质量分数A=B
D. 图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】关于锌铜—稀硫酸原电池的叙述,正确的是( )
A. 氢离子在铜表面被氧化,产生气泡
B. 溶液中的阴离子SO42-移向负极
C. 电子经导线从负极流向正极,再经溶液从正极流向负片
D. 金属铜参与了电极反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com