
科目: 来源: 题型:
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为 。
(2)反应2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g)在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
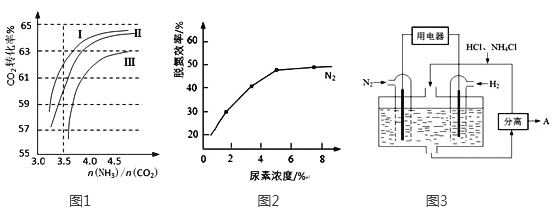
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61
生产中应选用水碳比的数值为 (选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是 。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO22HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量大约为20%)。
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为 %。
(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式 。生产中可分离出的物质A的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用下列装置制取高纯度的苯甲酸甲酯。
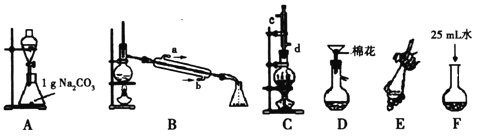
有关数据如下表:
熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 | |
苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
甲醇 | -97 | 64.3 | 0.79 | 互溶 |
苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
(1)在烧瓶中混合有机物及浓硫酸的方法是__________________________________,在实际实验中,甲醇、苯甲酸的物质的量之比远大于理论上物质的量之比,目的是_______________。装置C中除甲醇、苯甲酸与浓硫酸外还需要放置____________________________。
(2)B装置需加热的玻璃仪器的名称__________,C装置上部的冷凝管的主要作用是_____________________。冷却剂在冷凝管中的流动方向是__________。
(3)制备和提纯苯甲酸甲酯的操作先后顺序为(填装置字母代号)________________。
(4)A中Na2CO3的作用是_____________________;D装置的作用是_______________;当B装置中温度计显示_____________℃时可收集苯甲酸甲酯。
查看答案和解析>>
科目: 来源: 题型:
【题目】对Na、Mg、Al的有关性质的叙述不正确的是
A.原子半径:Na>Mg>AlB.电负性:Na<Mg<Al
C.第一电离能:Na<Mg<AlD.碱性:NaOH>Mg(OH)2>Al(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)最近有人利用反应“2C4H10+13O2=8CO2+10H2O”制造了一种燃料电池,一个电极通入空气,另一电极通入丁烷,电池的电解质是掺杂了Y2O3(三氧化二钇)的ZrO2(二氧化锆)晶体,它在高温下能传导O2-。试回答下列问题:

固体电解质中的O2-向 极移动(填“正”或“负”);写出该燃料电池的电极反应式:电池正极 ;电池负极 。
(2)用如图装置电解MnSO4溶液制MnO2时,A极为: 极, A电极电极反应式为 ;a极为: 极,电解MnSO4溶液制MnO2的化学方程式 。电解一段时间后, 溶液的pH将 (填“增大”、“减小”或“不变”)。
(3)精炼铜时,粗铜应与直流电源的____________极(填“正”或“负”)相连,阴极的电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 非金属单质中一定存在共价键
B. 金属元素和非金属元素形成的化合物一定是离子化合物
C. 含共价键的化合物不一定是共价化合物
D. 溶于水能导电的化合物就是离子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】[2015·北京]某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH=== Cl+ ClO+ H2O
B.该消毒液的pH约为12:ClO+ H2O![]() HClO+ OH
HClO+ OH
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl+ ClO=== Cl2 ↑+ H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO===HClO+ CH3COO
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯氧化铁是现代电子工业的重要材料。以下是用硫酸厂产生的烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁a-Fe2O3)的生产流程示意图:

(1)酸浸时,常需将烧渣粉碎、并加入过量H2SO4,其目的是 ;
滤渣的主要成分为 (填化学式)。
(2)加入FeS2时,发生反应②的离子方程式为 。
(3)加入NH4HCO3目的是 。“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是 。检验FeCO3是否洗涤干净的方法是 。
(4)煅烧时,发生反应④的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是

A. 元素W的最高价氧化物对应水化物的酸性比Q的强
B. 离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
C. 元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D. X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
科目: 来源: 题型:
【题目】将过量的金属锌投入热浓硫酸中,下列判断正确的是
A. 金属锌表面因生成致密氧化膜而不反应
B. 会立即生成H2
C. 会立即生成SO2,且只生成SO2
D. 除了SO2外,还会有H2产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com