
科目: 来源: 题型:
【题目】有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的Na+的物质的量浓度(单位:mol·L-1)为
A.(y-2x)/a B.(y-x)/a C.(2y-4x)/a D.(2y-2x)/a
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是( )
A.天然气在空气中燃烧的反应 B.灼热的木炭与CO2的反应
C.铁粉与稀硫酸的反应 D.Ba(OH)2 8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目: 来源: 题型:
【题目】化学探究学习小组的同学用下图所示装置制取氯气并探究氯气的某些性质。
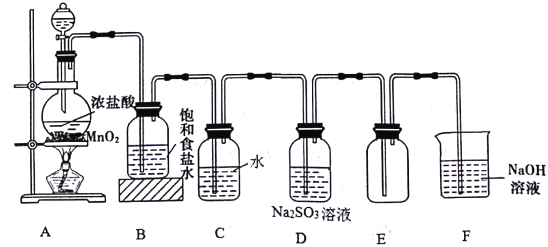
(1)装置A中制取Cl2的化学方程式为________________________。
(2)装置C中发生反应的离子方程式为_________________,反应后溶液中含Cl元素的分子有_________。
(3)实验结束后,测得装置D溶液中存在大量SO42-。Cl2通过装置D溶液时发生反应的离子方程式为 _____________ 。
(4)装置F的作用是______,该装置中发生反应的离子方程式______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NH3是一种重要的化工原料,可以制备一系列物质(见图)。下列说法正确的是
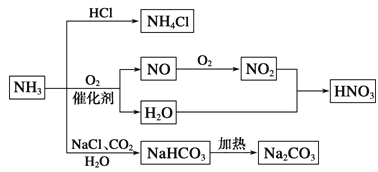
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.图中所涉及的反应均为氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对碱金属性质的叙述中,正确的是( )。
①都是银白色的柔软金属(除铯外),密度都比较小 ②单质在空气中燃烧生成的都是过氧化物 ③碱金属单质都与水剧烈反应 ④单质的熔、沸点随着原子序数的增加而升高
A. ①③ B. ②④ C. ①④ D. ②③
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g)。
2C1NO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)![]() 2C1NO(g) K3
2C1NO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):

则2NO(g)+C12(g)![]() 2C1NO(g)反应的ΔH和a的关系为ΔH =_____________kJ/mol。
2C1NO(g)反应的ΔH和a的关系为ΔH =_____________kJ/mol。
(3)300℃时,2NO(g)+C12(g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn(ClNO),测得速率和浓度的关系如下表:
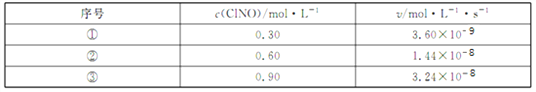
n =____________;k =__________________(注明单位)。
(4)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:

①该反应的ΔH ____________0(填“>”、“<”或“=”);
②反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min);
③T2时该反应的平衡常数K=____________。
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是____________点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属元素钫(Fr)在自然界中含量极少。它的21个已知同位素都有放射性。它是碱金属元素中最重的元素。根据它在周期表中的位置预言其性质,其中不正确的是( )。
A. 在已知碱金属元素中具有最大的原子半径
B. 在空气中燃烧时生成氧化物Fr2O
C. 氧化物对应的水化物是极强的碱
D. 其单质的熔点比金属钠的熔点低
查看答案和解析>>
科目: 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O![]() O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是
O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是
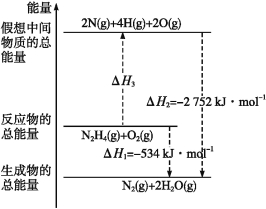
A.194 B.391 C.516 D.658
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,某同学设计一个甲醚燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)写出负极的电极反应式_____________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将____(填“增大”、“ 减小”或“不变”)。
(4)若在标准状况下,有2.24L氧气参加反应,则丙装置中阴极析出铜的质量为______。假设乙装置中氯化钠溶液足够多,若在标准状况下,有224mL氧气参加反应,则乙装置中阳离子交换膜左侧溶液质量将____________(填“增大”、“减小”或“不变”),且变化了_______克。
(5)若将乙装置中铁电极与石墨电极位置互换,其他装置不变,此时乙装置中发生的总反应式为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com