
科目: 来源: 题型:
【题目】取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入直馏汽油、苯、酒精、NaBr溶液,振荡后静置,现象正确的是
A.Ⅰ中溶液分层,下层呈紫红色
B.Ⅱ中溶液分层,上层呈紫红色
C.Ⅲ中溶液分层,下层呈黄褐色
D.Ⅳ中溶液不分层,溶液由黄褐色变成黄绿色
查看答案和解析>>
科目: 来源: 题型:
【题目】如图,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的水蒸气,并靠近火焰点燃。

(1)写出该反应的化学方程式___________________,氧化剂是____________。
(2)加热烧瓶的作用是__________________________,烧瓶底部放了几片碎瓷片,其作用是__________。干燥管里可装入的试剂是___________,其作用是_______________________。
(3)实验开始时应先点燃___________(填“酒精灯”或“酒精喷灯”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)含0.4 mol Al2(SO4)3的溶液中,含________mol SO![]() 。
。
(2)配制480mL 1mol/L 的NaOH溶液,需要称量氢氧化钠固体的质量为_______。
(3)若m g某气体中含分子数N个,已知阿伏加德罗常数为NA,则该气体的摩尔质量为____。
(4)O2和N2组成的混合气体的平均相对分子质量是31,则O2和N2的物质的量比为__________。
(5)在反应2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O中,氧化剂是________。
2ClO2↑+K2SO4+2CO2↑+2H2O中,氧化剂是________。
(6)分别取0.1mol 钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是 ____________;若0.2mol 钠、镁、铝分别放入到10mL 1mol/L 的盐酸中,在标准状况下,产生氢气体积分别为V1、V2、V3,则三者的大小顺序是____________(用V1、V2、V3填写)
(7)现有下列物质①NaCl晶体②干冰③HCl④铜⑤CaCO3固体⑥葡萄糖⑦酒精⑧熔融的KNO3⑨液氧⑩稀硫酸。以上物质能导电的是_________________。
(8)在粗盐提纯的实验中,判断BaCl2溶液过量的实验操作方法是______________。
(9)胃酸中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打,能治疗胃酸过多,请写出其反应的离子方程式________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称"引火铁"。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和"引火铁",实验中必须使用普通铁粉和6摩/升盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。

按要求填写下列空白:
(1)实验进行时试管A中应加入的试剂是__________;烧瓶B的作用是___ ;烧瓶C的作用是___________________;在试管D中收集得到的是____________。
(2)实验时,U型管G中应加入的试剂是____________;长颈漏斗H中应加入____。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)____________。
(4)试管E中发生反应的化学方程式是______________________________。
(5)为了安全,在E管中的反应发生前,在F出口处必须_____;E管中的反应开始后,在F出口处应____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在298 K、100 kPa时,已知:①2H2O(g)===O2(g)+2H2(g)ΔH1
②Cl2(g)+H2(g)===2HCl(g)ΔH2
③2Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)原电池反应通常是放热反应,下列反应中在理论上可设计成原电池的反应为________(填字母), 理由是_______________________________________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(l) △H>0
C.CaC2(s)+2H2O(l)=Ca(OH)2(s)+C2H2(g) △H <0
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H <0
(2)以KOH溶液为电解质溶液,依据(1)所选反应设计原电池,其负极反应为________________。
(3)电解原理在化学工业中有着广泛的应用,现将设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y为两块电极板,则:

①若X和Y均为惰性电极,a为饱和NaCl溶液,则电解时检验Y电极反应产物的方法是___________。
②若X和Y分别为石墨和铁,a仍为饱和NaCl溶液,则电解过程中生成的白色固体物质露置在空气中,可观察到的现象是________________________________。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 molCuO,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯及其化合物有广泛用途。
(1)二氧化氯是一种新型的消毒剂。
①NaClO2中Cl的化合价为____________。
②实验室用氯酸钾与浓盐酸反应制备ClO2,产物除ClO2外,还有Cl2,KCl等,写出该反应的化学方程式 __________。若生成11.2L氯气(标准状况),转移电子数为 _________。
③ClO2和Cl2在消毒时自身均被还原为Cl-,则常温常压下,等体积的ClO2的消毒能力是Cl2的_________倍。
④自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1﹣0.8 mgL-1之间。碘量法可以检测水中ClO2的浓度(不同pH环境中粒子种类如图所示),步骤如下:
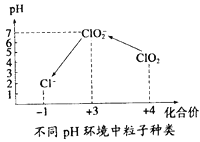
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再将反应后溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(己知:2S2O32-+I2═S4O62-+2I-)
Ⅲ.加硫酸调节水样pH至1﹣3。
请问答:
若水样的体积为1.0L,在操作II时消耗了1.0×10-3molL-1的Na2S2O3溶液10mL.则水样中ClO2的浓度是_____ mgL-1。
(2)ICl,ICl3的化学性质与卤素相似,被称为卤素互化物。三氯化碘(ICl3,其中Cl为-1价)常以二聚体的I2Cl6形式存在,经电导仪测定知,它能发生部分电离,生成的两种离子的摩尔质量分别为198 g/mol和269 g/mol,则其电离方程式为 ________________ 。
(3)向盛有一定量的溴化亚铁溶液和四氯化碳溶液的试管中持续通入氯气,反应完毕后,振荡、静置、分层,发现有机层呈红棕色,经检验生成了BrCl(其中Cl为-1价)。可能发生如下反应:
①2Br-+Cl2=2Cl-+Br2 ②Br2+Cl2=2BrCl ③2Fe2++Cl2=2Fe3++2Cl-
按通入氯气,发生先后反应的顺序为 ____________(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
A. 0.5 mol H2O所含的电子数为5NA
B. 1 mol NH4+ 所含质子数为10NA
C. 标准状况下,22.4 L CO2所含的分子数为NA
D. 常温常压下,32 g O2和O3的混合气体所含氧原子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. NH4F的水溶液不能存放在玻璃试剂瓶中
B. SiO2有导电性,所以SiO2可用于制备光导纤维
C. “天宫一号”使用的碳纤维,是一种新型有机高分子材料
D. 石英玻璃的主要成分是硅酸盐,可制作化学精密仪器
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com