
科目: 来源: 题型:
【题目】下列说法正确的是
A. c(H+)=10—7mol·L-1的溶液一定是中性溶液
B. 醋酸钠溶液中![]()
C. 常温下,在1mol·L—1的盐酸中加入等体积等浓度的氨水,溶液导电能力减弱
D. 同浓度同体积的醋酸和盐酸溶液分别与足量锌反应,盐酸消耗的锌比较多
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 石墨和C70是同素异形体 B. 某烷烃的名称是3—甲基丁烷
C. 冰醋酸CH3COOH和无水乙醇C2H518OH的混合物中含有三种核素 D. 乙二醇![]() 和丙三醇
和丙三醇![]() 是同系物
是同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组利用反应Zn+2FeCl3=ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是
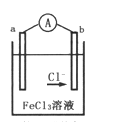
A. Zn为负极,发生还原反应
B. a电极反应式为Zn-2e—=Zn2+
C. 电子流动方向是a电极![]() FeCl3溶液
FeCl3溶液![]() b电极
b电极
D. 电池的正极材料可以选用石墨、铂电极,也可以用铜电极
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃,将2 mol X和1 mol Y充入体积为1L的密闭容器中,已知:2X(s)+Y(g) ![]() 2Z(g) △H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是
2Z(g) △H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是
A. 在第10 min时,Z的反应速率为0.02 mol·L-1·min-l
B. 在0~10 min内,Y的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
C. 增加X的物质的量可以加快反应速率
D. 反应达平衡后,保持T℃,通入稀有气体增加压强,则化学反应速率变快
查看答案和解析>>
科目: 来源: 题型:
【题目】随着各地治霾力度的加大,大力发展高性能燃料电池汽车成为研究课题。如图是某课题组设计的液体燃料电池示意图。下列有关叙述不正确的是

A. 该电池的优点是不产生污染气体,且液体燃料便于携带
B. 电池内部使用的是阴离子交换膜,OH-经交换膜移向负极
C. 该燃料电池的电极材料采用多孔纳米碳材料(如图),目的是增大接触面积,增加吸附量
D. 该电池中通入N2H4的电极为正极,发生的电极反应式为N2H4+4OH--4e-=N2↑+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某芳香烃的分子式为C10H14 ,不能使溴水褪色,但可使酸性KMnO4溶液褪色,分子结构中含有两个烷基,则此烃的结构共有( )
A. 6种 B. 7种 C. 8种 D. 9种
查看答案和解析>>
科目: 来源: 题型:
【题目】热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
(1)已知反应CH3—CH3(g) → CH2=CH2(g)+H2(g),有关化学键键能如下。
化学键 | C—H | C=C | C—C | H—H |
键能/kJ·mol-1 | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热___________________________
(2)已知H2(g)+Br2(l)=2HBr(g);ΔH=-72 kJ/mol。蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其它相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1 mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | a | 369 |
则表中a为__________
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。试依据下列热化学方程式,计算反应
2C(s)+2H2(g)+O2(g)=CH3COOH(l)的焓变ΔH=________。
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
(4)如下图Ⅰ所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________________________________________________________________。
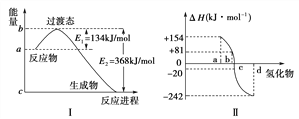
(5)图Ⅱ表示氧族元素中的氧、硫、硒(Se)、碲(Te)在生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢发生分解反应的热化学方程式:_____________________。
(6)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g);ΔH=-25 kJ·mol-1,
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);ΔH=-47 kJ·mol-1,
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH=+19 kJ·mol-1
请写出CO还原FeO的热化学方程式:__________________________。
(7) 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。热化学方程式为:N2H4(l) + 2H2O2(l) == N2(g) + 4 H2O(g) △ H=-644.25 kJ/molspan>。又已知H2O (l) == H2O (g) ΔH=+ 44 kJ/mol。则64g液态肼
与液态双氧水反应生成液态水时放出的热量是 _________________ kJ。
(8)焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中不正确的是( )
A. 硫是一种淡黄色、难溶于水的固体
B. 硫的化合物常存在于火山喷出物中
C. 大量排放二氧化硫会导致酸雨的形成
D. 硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,下列各组离子在指定溶液中一定能大量共存的是
A. pH=1的无色溶液中:Na+、Cu2+、Cl-、![]()
B. 使酚酞呈红色的溶液中:K+、Na+、NO3-、Cl-
C. 0.1 mol·L-1的FeCl2溶液中:H+、Al3+、SO42-、S2-
D. 由水电离出的c(H+)=1×10-10 mol·L-1的溶液中:Mg2+、NH4+、SO42-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com