
科目: 来源: 题型:
【题目】下列事实不能用元素周期律解释的是
A. Mg、Al与同浓度盐酸反应,Mg更剧烈 B. 向Na2SO3溶液中加盐酸,有气泡产生
C. 0.1 mol·L-1 溶液的碱性:MaOH>LiOH D. 气态氢化物的稳定性:HBr>HI
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列要求,写出有关反应的化学方程式
(1)实验室制取氢气______________。
(2)用化学方法除去铜粉中的氧化铜________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
①物质燃烧一定是放热反应②需要加热才能发生的反应一定是吸热反应③放热的化学反应不需要加热就能发生④反应是放出能量还是吸收能量取决于反应物和生成物所具有的总能量的相对大小
A. ③④ B. ①④ C. ②④ D. ②③
查看答案和解析>>
科目: 来源: 题型:
【题目】由H、Na、Mg、S、O、Cl六种元素组成的物质,按要求,每小题各写出一个化学方程式
(1)是化合反应又是氧化还原反应的 .
(2)是分解反应又是氧化还原反应的 .
(3)是氧化还原反应又是置换反应的 .
(4)写出酸性氧化物与可溶性碱反应的化学方程式 .
(5)写出碱性氧化物与水反应的化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】“C化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2 (g)+3H2(g)CH3OH g)+H2O(g)△H=﹣49.0kJ/mol.
相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时转化率 | a | b |
平衡时能量变化 | 放出29.4kJ | 吸收 c kJ |
请回答:
①c1__c2(填“>”、“<”或“=”);c=__kJ.
②同温同体积甲、乙达平衡时:a+b=_____,若甲、乙为体积相同的绝热容器,达平衡时a+b__________
(2)压强为p1时,向体积为1L的密闭容器中充入b mol CO 和2b mol H2,发生反应CO (g)+2H2(g)CH3OH(g).平衡时CO的转化率与温度、压强的关系如图所示.请回答:该反应属于__(填“吸热”或“放热”)反应;p1 __p2(填“>”、“<”或“=”)

(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)2CO2(g)+N2(g)△H<0.在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是__(选填字母).

查看答案和解析>>
科目: 来源: 题型:
【题目】完成以下计算:
(1)3.01×1023个氨分子的质量为: .
(2)标准状况下,L氨气中氢原子数与98g的硫酸中氢原子数相同.
(3)2.4mol Cl2与元素R单质完全反应生成1.6mol RClx,则x值为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学在化学工业有着广泛的应用,
(1)工业冶炼铝的化学方程式是___________________________;
(2)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换法膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
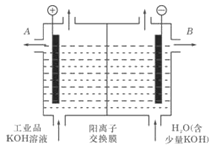
①该电解槽的阳极反应式是________________________;
②除去杂质后的氢氧化钾溶液从液体出口__________(填写“A”或“B”)导出。
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。其工作原理如右图,质子交换膜左右两侧的溶液均为1L 1.5 mol/L H2SO4 溶液。
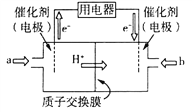
①通入气体a的电极是电池的________(填“正”或“负”)极,其电极反应式为___________________________________;
②当电池中有2 mol e-发生转移时,左右两侧溶液的质量差值为_________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】
实验室以有机物 A、E 为原料,制备聚酯纤维 M 和药物中间体 N 的一种合成路线如下:

已知: ①A 的核磁共振氢谱有 3 组峰
②
③ ( R1、R2、R3、R4 表示烃基)
( R1、R2、R3、R4 表示烃基)
请回答下列问题:
(1) A 的化学名称为_________。
(2) J 的结构简式为_________。
(3) B→C、G→H 的反应类型分别为_________、_________。
(4) D+I→M 的化学方程式为_________。
(5) 同时满足下列条件的 N 的同分异构体有_________种( 不考虑立体异构), 其中任意一种的结构简式为_________。
①饱和五元碳环上连有两个取代基
②能与 NaHCO3溶液反应
③能发生银镜反应
(6) 参照上述合成路线和信息, 以环庚醇和甲醇为有机原料( 无机试剂任选), 设计制备![]() 的合成路线_____________________。
的合成路线_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒性PH3气体(熔点为-132°C,还原性强)。卫生安全标准规定:粮食中磷化物(以PH3计)的含量不超过0.05mg·kg-1时,粮食质量合格;反之,粮食质量不合格。某化学兴趣小组的同学通过下列方法对粮食中残留的磷化物含量进行了探究。
【操作流程】
安装实验装置→PH3的产生与吸收→转移KMnO4吸收溶液→滴定亚硫酸钠标准溶液
【实验装置】

已知装置C中盛有l00g原粮,装置E中盛有20.00mLl.ll×l0-3 mol·L-1 KMnO4溶液(H2SO4酸化)。
回答下列问题:
(1)仪器D的名称是____________________________________。
(2)装置B中盛有焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止装置C中生成的PH3被氧化,则装置A中盛装KMnO4溶液的作用是_____________________________。
(3)通入空气的作用是_____________________________。
(4)已知PH3被氧化成磷酸,则装置E中发生反应的离子方程式为___________________________。
(5)收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×l0-4 mol·L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为________________mg·kg-1,该原粮质量是否合格?________________(填“合格”或“不合格”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com