
科目: 来源: 题型:
【题目】现在探索、开发的新能源有:( )
①核能 ②柴草 ③煤炭 ④太阳能 ⑤氢能 ⑥液化石油气 ⑦水煤气 ⑧天然气
A.①④⑤B.②③⑥⑦C.③⑥⑦⑧D.①②④
查看答案和解析>>
科目: 来源: 题型:
【题目】两种短周期元素组成的化合物中,原子个数比为1:3,若两种元素的原子序数分别为a和b,则a和b的关系可能是( )
① a=b+5 ② a+b=8 ③ a+b=30 ④ a=b+8
A. ①②③④ B. ②③④ C. ②③ D. ③④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.纯水的pH不一定等于7
B.原电池的两极中较活泼的金属一定为负极
C.硫酸溶液的导电能力一定比醋酸溶液的导电能力强
D.若升高一个可逆反应的温度,该反应化学平衡常数一定增大
查看答案和解析>>
科目: 来源: 题型:
【题目】用向下排气法在容积为V mL的集气瓶中收集氨气,由于空气尚未排净,最后瓶内气体的平均相对分子质量为19,将此盛满气体的集气瓶倒置于水中,瓶内水马上升到一定高度后,即停止上升,则在同温同压下,瓶内剩余气体的体积为
A. V/4mL B. V/5mL C. V/6mL D. 无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CH3COO-、OH-、Cl-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象。
⑴A是_________,B是______________(填化学式)。
用离子方程式表示A的水溶液中存在的平衡关系:_______________________。
(2)写出C和D反应的离子方程式____________________。
(3)25℃时,0.1 mol·L-1 B 溶液的 pH=a,则B溶液中:C(H+) -c(OH-)=_______(填微粒浓度符号)=____(用含有a的关系式表示)。
⑷将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是___________。
(5)在一定体积的0.005 mol·L-1的C溶液中,加入一定体积的0.00125mol·L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则c溶液与盐酸的体积比是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的量浓度均为1mol/L的①NaOH ②Ba(OH)2 ③Na2CO3 ④Na2SiO3四种溶液,pH由小到大的顺序是
A.④③②①B.③④①②C.①②③④D.①②④③
查看答案和解析>>
科目: 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂。某课题组经查阅资料后设计合成铝氢化钠的流程如图所示。

已知:①AlCl3、NaH、NaAlH4遇水都能迅速发生反应。
②常温下,可用高锰酸钾、氯酸钾、重铬酸钾、次氯酸钙等与浓盐酸反应制取氯气。
(1)铝氢化钠遇水发生剧烈反应,甚至可能发生爆炸,其原因是_______
写出铝氢化钠与水反应的化学方程式_________
(2)甲同学设计实验制备无水氯化铝的装置如图所示。
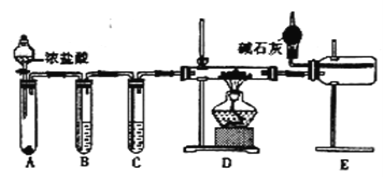
①装置E中干燥管的作用是_______________________。
②点燃装置D处酒精灯之前 需先排尽装置内的空气,其操作方法是______。
(3)乙同学分析甲同学设计的装置后,认为只改变A、B、D中的试剂就可以用甲同学设计的装置制备NaH。
①试管B中的试剂改为____________________。
②若操作不当,则制得的NaH产品中可能含有的杂质有_______。
(4)丙同学设计以下3种装置测定铝氢化钠样品的纯度(假设杂质不参与反应)。
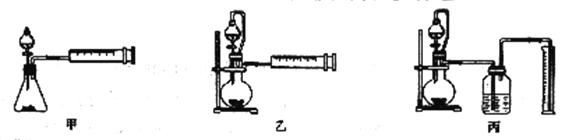
从易操作性、准确性角度考虑宜选装置___。如何判断铝氢化钠与水完全反应:___
查看答案和解析>>
科目: 来源: 题型:
【题目】今有浓度均为1.5molL﹣1的氢氧化钠和硫酸溶液各200mL,分别加入等质量的Al粉,反应完毕后生成气体的质量之比为4:3,下列说法正确的是( )
A.与H2SO4反应的铝粉7.2g
B.参加反应的H2SO4为0.2mol
C.铝与NaOH反应中消耗氧化剂约0.53mol
D.参加反应的NaOH约为0.27mol
查看答案和解析>>
科目: 来源: 题型:
【题目】100mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42﹣的物质的量浓度约为( )
A.0.20mol/L
B.0.25mol/L
C.0.4mol/L
D.0.5mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com