
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 1H,2H,3H互为同素异形体 B. O2、O3互为同位素
C. 乙烷、乙烯互为同系物 D. 正丁烷和异丁烷互为同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列气体通入溶液中一定不会出现浑浊的是
A.CO2通入Ca(OH)2溶液中B.SO2通入Ba(NO3)2溶液中
C.SO2通入BaCl2溶液中D.Cl2通入氢硫酸溶液中
查看答案和解析>>
科目: 来源: 题型:
【题目】1905年德国化学家哈伯发明了合成氨的方法.他因此获得了1918年度诺贝尔化学奖.哈伯法合成氨需要在20﹣50MPa的高压和500℃的高温下,用铁作催化剂,且氨转化率10%﹣15%.2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物.用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2 ![]() 2NH3 , 有关说法正确的是( )
2NH3 , 有关说法正确的是( )
A.不同的催化剂对化学反应速率影响均相同
B.新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景
C.新法合成能在常温下进行是因为不需要断裂化学键
D.哈伯法合成氨是吸热反应,新法合成氨是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】向相同容积的甲乙两容器中都分别充入1molSO2和0.5molO2,若甲容器保持温度容积不变,乙容器保持温度压强不变,分别达到平衡,下列说法正确的是
A. 平衡时,容器内的压强:甲>乙 B. 反应达到平衡时所需时间:甲<乙
C. 平衡时,氧气的浓度:甲<乙 D. 平衡时,容器内SO3的体积百分数:甲>乙
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8 kJ/mol
B. 已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 已知2C(s)+2O2(g)=2CO2(g) △H1; 2C(s)+O2(g)=2CO(g) △H2;,则△H1>△H2
D. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应中和热的热方程式为NaOH(aq)+ HCl(aq)=NaCl(aq)+H2O(l) △H=一57.4kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在100mL含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol·L-1NaOH溶液,所加NaOH 溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是( )
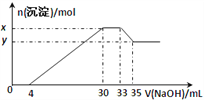
A. x-y=2×10-3mol
B. 原溶液中n(Cu2+)=0.025mol
C. 原溶液的pH=2
D. 原溶液中c(NH4+)=7.5×10-3mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】用50mL0.50mol·L-1的盐酸与50mL0.55mol·L-1的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题。

(1)仪器A的名称是____________________________________。
(2)A的材质能否用铁质的代替?_______(填“能”或“不能”),其原因是:________。
(3)实验时氢氧化钠溶液的浓度要用0.55mol·L-1的原因是:______________。
实验中若改用60mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),若实验操作均正确,则所求中和热________(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1molH2O时,放出57.3kJ的热量,则上述反应的热化学方程式为:_________________________________________________。
(5)若用KOH代替NaOH,对测定结果________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果________(填“有”或“无”)影响。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com