
【题目】用50mL0.50mol·L-1的盐酸与50mL0.55mol·L-1的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题。

(1)仪器A的名称是____________________________________。
(2)A的材质能否用铁质的代替?_______(填“能”或“不能”),其原因是:________。
(3)实验时氢氧化钠溶液的浓度要用0.55mol·L-1的原因是:______________。
实验中若改用60mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),若实验操作均正确,则所求中和热________(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1molH2O时,放出57.3kJ的热量,则上述反应的热化学方程式为:_________________________________________________。
(5)若用KOH代替NaOH,对测定结果________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果________(填“有”或“无”)影响。
【答案】 环形玻璃搅拌棒 不能 金属铁易导热,容易造成热量的散失,引起较大的实验误差 保证0.50mol/L的盐酸完全被NaOH中和 不相等 相等 HCl(aq)+NaOH(aq) = NaCl(aq)+H2O( l ) ΔH=-57.3 KJ/mol 无 有
【解析】(1)仪器A的名称是环形玻璃搅拌棒;(2)A的材质应导热能力差,不能用铁质的代替,金属铁易导热,容易造成热量的散失,引起较大的实验误差;(3)用50ml0.50mol·L-1盐酸跟50ml0.55mol·L-1NaOH溶液进行反应,NaOH完全反应,保证0.50mol/L的盐酸完全被NaOH中和;实验中改用60ml0.50mol·L-1盐酸跟50ml0.55mol·L-1NaOH溶液进行反应,NaOH完全反应,生成水的量不同,则放出的热量不同,但中和热为固定值,不发生变化;(4)已知在稀溶液中,强酸和强碱发生中和反应生成1molH2O时,放出57.3kJ的热量,则上述反应的热化学方程式为HCl(aq)+NaOH(aq) = NaCl(aq)+H2O( l ) ΔH=-57.3 KJ/mol;(5)若用KOH代替NaOH,本质均为H++OH―=H2O,对测定结果无影响;醋酸是弱电解质,电离要吸热,若用醋酸代替HCl做实验,对测定结果有影响。


科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液时,由于操作不小心,使得容量瓶内的液面超过了刻度线,此时应采取的措施是
A. 倒出刻度线以上的溶液 B. 用胶头滴管吸出刻度线以上的溶液
C. 重新配制 D. 影响不大,不作处理即可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)与钢铁比,纯净的铁有很强的抗腐蚀性,原因是____。氯化铁受热会发生升华现象,这说明氯化铁是______(选填“离子”、“共价”)化合物。
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g),该反应的平衡常数表达式K=_____________。下列措施中能使平衡时c(CO)/c(CO2)增大的是________(选填编号)
FeO(s)+CO(g),该反应的平衡常数表达式K=_____________。下列措施中能使平衡时c(CO)/c(CO2)增大的是________(选填编号)
a.升高温度 b.增大压强 c.充入一定量CO d.再加入一些铁粉
(3)FeS2可在Fe2(SO4)3溶液中“溶解”,硫元素都以SO42-形式存在,请完成该反应的化学方程式。
______________________________________________________________________
(4)溶液的酸碱性对许多物质的氧化性有很大影响;生成物的溶解性会影响复分解反应的方向。将Na2S溶液滴加到FeCl3溶液中,有单质硫生成;将FeCl3溶液滴加到Na2S溶液中生成的是Fe2S3而不是S或Fe(OH)3从以上反应可得出的结论是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子。经测定Fe3+、SO42-、Al3+和M离子的物质的量浓度之比为1:4:1:2,则M离子可能是下列中的( )
A. Cl- B. OH- C. Na+ D. Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙烯的分子式可写成(CH2)2
B. 乙烯的最简式为CH—CH
C. 乙烯分子是空间平面结构
D. 乙烯的结构简式为CH2CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1905年德国化学家哈伯发明了合成氨的方法.他因此获得了1918年度诺贝尔化学奖.哈伯法合成氨需要在20﹣50MPa的高压和500℃的高温下,用铁作催化剂,且氨转化率10%﹣15%.2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物.用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2 ![]() 2NH3 , 有关说法正确的是( )
2NH3 , 有关说法正确的是( )
A.不同的催化剂对化学反应速率影响均相同
B.新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景
C.新法合成能在常温下进行是因为不需要断裂化学键
D.哈伯法合成氨是吸热反应,新法合成氨是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为: . 反应开始至2min,Z的平均反应速率为 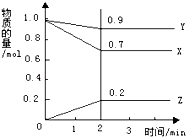
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列5种烃:①CH3CH2CH(CH3)2 ②CH3C(CH3)3 ③丙烷 ④戊烷 ⑤CH3CH(CH3)2,其沸点按由高到 低的顺序排列正确的是
A. ①②③④⑤ B. ②③④⑤①
C. ⑤②①③④ D. ④①②⑤③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com