
科目: 来源: 题型:阅读理解
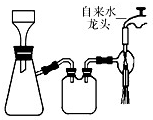 (2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下:
(2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下:查看答案和解析>>
科目: 来源: 题型:
 (2013?江苏三模)研究证明,Fe、Fe2+、Fe3+易与CO、CN-等形成配合物.
(2013?江苏三模)研究证明,Fe、Fe2+、Fe3+易与CO、CN-等形成配合物.查看答案和解析>>
科目: 来源: 题型:阅读理解
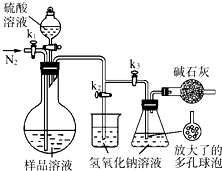
 (2013?江苏三模)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
(2013?江苏三模)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.查看答案和解析>>
科目: 来源: 题型:阅读理解
 (2013?江苏三模)碳酸钠-过氧化氢加合物(aNa2CO3?bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
(2013?江苏三模)碳酸钠-过氧化氢加合物(aNa2CO3?bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
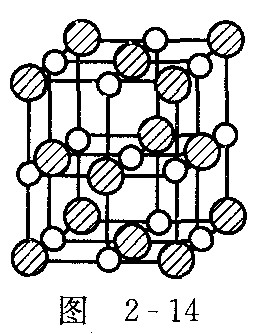
最近发现一种由钛原子和碳原子构成的气态团簇分子,如右图2-14所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是_____________.
查看答案和解析>>
科目: 来源: 题型:
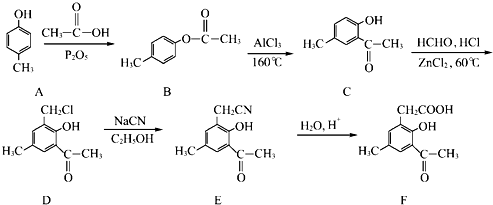
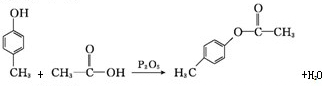

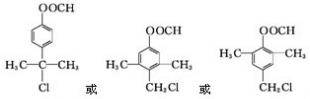

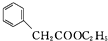 )是一种重要的化工原料.请写出以苯、甲醛和乙醇为主要原料制备苯乙酸乙酯的合成路线流程图
)是一种重要的化工原料.请写出以苯、甲醛和乙醇为主要原料制备苯乙酸乙酯的合成路线流程图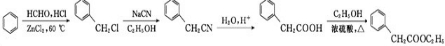
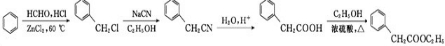
| HBr |
| NaOH溶液 |
查看答案和解析>>
科目: 来源: 题型:
| c(Ti3+)2?c(Fe2+)2 |
| c(TiO2+)2?c(H+)4 |
| c(Ti3+)2?c(Fe2+)2 |
| c(TiO2+)2?c(H+)4 |
查看答案和解析>>
科目: 来源: 题型:
(2013?江苏三模)80℃时,将0.40mol的N2O4气体充入容积为2L的恒容密闭容器中,发生反应:N2O4(g)?2NO2(g).反应过程中测定的部分数据见下表:
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com