
科目: 来源: 题型:
【题目】下列有关高分子材料的说法中,不正确的是( )
A.聚氯乙烯在建筑材料、人造革、管材、食品包装膜等方面均有广泛应用
B.橡胶硫化可提高橡胶制品的强度,汽车轮胎使用的便是硫化橡胶
C.高分子分离膜应用于食品工业中,可用于浓缩天然果汁、乳制品加工、酿造业等
D.人造器官使用的是生物医用仿生高分子材料,具有较好的生物相容性
查看答案和解析>>
科目: 来源: 题型:
【题目】现有短周期元素X形成的单质A与NaOH溶液反应,有如下转化关系 ![]() ,(若产物中有水生成则省略未表示出来).
,(若产物中有水生成则省略未表示出来).
(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为;
(2)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为;
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途.一个探究性学习小组,他们拟用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下: 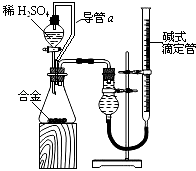
①装置中导管a的作用是平衡分液漏斗上下管口的压强,有利于液体滴下和;
②实验中准确测得4个数据:实验前该合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL;则通常状况时气体摩尔体积Vm=LmoL﹣1 .
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ. 在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
(1)用D表示2 min内的平均反应速率为________,A的转化率为________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度________(填“增大”、“减
少”或“不变”)。
(3)若开始时只加C和D各4/3 mol,要使平衡时各物质的质量分数与原平衡相等,则还应加
入______ mol B物质。
(4)若向原平衡体系中再投入1 mol A和1 mol B,平衡________(填“右移”、“左移”或“不
移动”)。
Ⅱ.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则 :
①每消耗1 mol CH4可以向外电路提供____ mol e-;
②负极电极反应式为__________________________________________;
③电池放电后,溶液的pH不断________。
查看答案和解析>>
科目: 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
Ⅰ.(1)同浓度的CH3COO-、HCO、CO![]() 、HC2O4- 、ClO-、S2-结合H+的能力最弱的____________。
、HC2O4- 、ClO-、S2-结合H+的能力最弱的____________。
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的
是________(填序号)。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D. ![]()
若该溶液升高温度,上述4种表达式的数据增大的是_________________。
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH 变化如图所示,则稀释后,醋酸溶液中由水电离出来的c(H+)_______(填“大于”、“等于”或“小于”)HX 溶液中由水电离出来的c(H+)。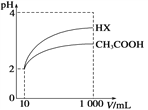
Ⅱ.(1)下列化学方程式可能正确的是______________。
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
(2)写出过量CO2通入Na2S溶液中的离子方程式______________________________________。
(3)将过量的氯气通入到少量的碳酸钠溶液中_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分为主要成份是Al2O3 , 还含有SiO2和Fe2O3)提取氧化铝并冶炼Al的操作过程如下: 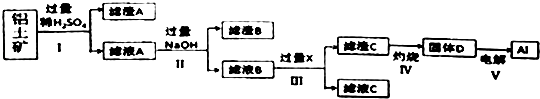
(1)滤渣A是 , 滤渣B是 .
(2)过程 I、II、III的分离操作的名称是 .
(3)过程 IV中灼烧时盛放药品的仪器名称是 , 发生反应的化学方程式是 .
(4)过程 III中发生反应生成滤渣C的离子方程式表示为 .
(5)取滤液B100mL,加入1molL﹣1盐酸200mL时,沉淀量达到最大且质量为11.7g.则溶液B中c(AlO2﹣)= , c(Na+)>molL﹣1 .
查看答案和解析>>
科目: 来源: 题型:
【题目】化学工业是国民经济的支柱产业。下列生产过程中不涉及化学变化的是( )
A. 氮肥厂用氢气和氮气合成氨 B. 钢铁厂用热还原法冶炼铁
C. 硫酸厂用接触法生产硫酸 D. 炼油厂用分馏法生产汽油
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于元素周期表的说法正确的是 ( )
A. 过渡元素全部都是副族元素 B. 短周期共有32 种元素
C. 元素周期表共七个横行代表七个周期,18 个纵横代表18 个族 D. 科学研究时,经常在过渡元素中寻找耐高温、耐腐蚀的合金材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com