
科目: 来源: 题型:
【题目】关于化学键的各种叙述,下列说法中不正确的是( )
A.Ca(OH)2中既有离子键又有共价键
B.在单质或化合物中,一定存在化学键
C.在离子化合物中,可能存在共价键
D.化学反应中肯定有化学键发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】NaC1O2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(l)NaClO2中Cl的化合价为__________。
(2)写出“反应”步骤中生成ClO2的化学方程式__________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为_____、__。“电解”中阴极反应的主要产物是___________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。写出此反应的化学方程式________。
(5) “有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2 的氧化能力。NaClO2 的有效氯含量为______。(计算结果保留两位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】在某水溶液样品中滴加氯化钡溶液,产生白色沉淀;再滴加盐酸,沉淀部分消失,并有无色无味的气体产生.由此判断该溶液中肯定不存在的离子是( )
A.Ag+B.SO42﹣C.CO32﹣D.NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】除去下列括号内杂质的试剂或方法正确的是( )
A.HNO3溶液(H2SO4):适量BaCl2溶液,过滤
B.乙烷(乙烯):催化剂条件下通入H2
C.溴苯(溴):加入KI溶液,分液
D.乙醇(乙酸):加入足量CaO后蒸馏
查看答案和解析>>
科目: 来源: 题型:
【题目】卤素化学丰富多彩,化合物类型多,如卤化物、卤素互化物、多卤化物等;还有拟卤素,形成的单质和化合物。
(1)溴元素在周期表中的位置为________________,碘原子的价层电子排布图为________________。
(2)气态氟化氢中存在二聚分子(HF)2。这是由于_______________________。
(3)I3+属于多卤素阳离子,其空间构型为_____________。中心原子的杂化轨道类型为______________。
(4)卤素互化物如IBr、ICl等与卤素单质结构和性质相似。Cl2、IBr、ICl沸点由高到低的顺序为__________。
(5)拟卤素(CN)2、(SCN)2等的性质也与卤素单质性质相似,其中(CN)2组成中电负性较大的元素是___________;写出与SCN-互为等电子体的微粒的化学式:______________(写两种),在硫酸铜溶液中加入过量KCN溶液生成的配离子[Cu(CN)4]2-的配位数为____________。
(6)请推测①HC1O4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为______________(填序号)。
(7)由卤族元素F和K、Ni三种元素组成的一种化合物的晶胞如图所示,该晶体的密度为dg·cm-3,则阿伏加德罗常数为_______________(只要求列出算式)。

查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可用草酸(H2C2O4)在浓硫酸的作用下分解得一氧化碳,某研究小组利用如图所示装置探究温度对CO还原Fe2O3的影响(固定装置略):

(1)草酸(H2C2O4)在浓硫酸的作用下分解制取一氧化碳的化学方程式为_____________________。
(2)装置C的作用是_______________,加热D装置之前需进行的操作是___________________。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀硫酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①甲组步骤1中反应的化学方程式为_________________________。
②甲组步骤3中,溶液变红的离子方程式为______________________。
③乙组得到的黑色粉末是_____________(填化学式)。
④乙组步骤4中,溶液褪色可能的原因及其验证方法为_______________________。
(4)该装置的改进措施除了在E装置后加尾气处理装置外还需_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铈是地壳中含量最高的稀土元素,二氧化铈(CeO2)是其重要的化合物。平板液晶显示屏生产过程中产生大量的废玻璃粉末,其中含CeO2、SiO2、Fe2O3等物质,某实验小组以此粉末为原料回收铈,设计流程如图所示:
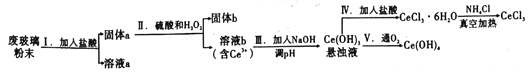
(1)步骤Ⅰ加入过量盐酸后,溶液a中的阳有离子___________________。
(2)步骤Ⅱ中反应的氧化剂和还原剂的物质的量之为___________。
(3)为了使步骤Ⅲ所得悬浊液中的Ce3+浓度为1×10-6mol·L-1,则加入NaOH调节溶液的pH应为____________[已知:Ce(OH)3的Ksp=8.0×10-21,lg2=0.3]。
(4)将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,其中加入NH4Cl的作用是__________。
(5)第Ⅴ步反应的化学方程式是____________________;用反应得到的悬浊液制备纯净的Ce(OH)4需进行的实验操作为______________。
(6)对CeCl3样品纯度进行测定的方法:准确称取样品wg配成100mL溶液,取25.00mL置于锥形瓶中,加入稍过量的过二硫酸铵[(NH4)2S2O8]溶液将Ce3+氧化为Ce4+,然后用萃取剂[用(HT2)表示]萃取Ce4+,再用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(其离子反应方程式为Ce4++Fe2+=Ce3++Fe3+),重复2~3次,平均消耗VmL标准溶液。
①“萃取”时存在反应:Ce4++n(HT)2![]() Ce(H2n-4)+4H+,若要提高滴定的准确率,应使溶液呈______性(填“酸”“中”或“碱”)。
Ce(H2n-4)+4H+,若要提高滴定的准确率,应使溶液呈______性(填“酸”“中”或“碱”)。
②经计算,CeCl3样品的纯度为________________。 [M(CeCl3)=246.5g·mol-1]
查看答案和解析>>
科目: 来源: 题型:
【题目】现有三组物质的分离:①含有水份的植物油中除去水份②回收碘的CCl4溶液中的CCl4③用食用酒精浸泡中草药提取其中的有效成分。分离以上各混合液的正确方法依次是()
A. 萃取、分液、蒸馏 B. 分液、蒸馏、萃取
C. 萃取、蒸馏、分液 D. 蒸馏、萃取、分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com