
科目: 来源: 题型:
【题目】某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究。
填写下列空白:
(1)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl对反应具有促进作用,而![]() 对反应没有影响;
对反应没有影响;
原因Ⅱ:________________________________________;
原因Ⅲ:Cl对反应具有促进作用,而![]() 对反应具有阻碍作用;
对反应具有阻碍作用;
原因Ⅳ:Cl、![]() 均对反应具有促进作用,但Cl影响更大;
均对反应具有促进作用,但Cl影响更大;
原因Ⅴ:_____________________________。
(2)该同学设计并进行了两组实验,即得出了正确的结论。他取了两片等质量、外形和组成相同、表面经过砂纸打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
①在盛有硫酸的试管中加入少量NaCl或KCl 固体,观察反应速率是否发生变化;
②在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否发生变化。若观察到实验1中__________,实验2中__________,则说明原因Ⅲ是正确的。以此类推,该同学通过分析实验现象,得出了结论:Cl对反应具有促进作用。
(3)为了使实验”定量化”,使结果更精确,可以对实验进行如下改进:
①配制c(H+)相同的稀盐酸和稀硫酸:现有浓度为1 mol L1的盐酸和密度为1.225 g cm3、质量分数为20%的硫酸,若要准确量取该硫酸20.00 mL,需要用酸式滴定管(一种能够精确测量溶液体积的仪器)将量取的硫酸配制成c(H+)=l molL1的溶液,可得溶液的体积为________________________________。配制溶液时还需要用到的玻璃仪器有______________、烧杯、胶头滴管和量筒等。
②比较反应速率:反应时间可以用停表测定。如果要对上述实验中的反应速率进行比较,可以通过测定哪些物理量来确定?要求回答一种即可。_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下KMnO4氧化浓HCl的反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用“双线桥法”标明反应中电子转移的方向和数目
(2)又已知MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: .
MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: .
(3)浓盐酸在反应中显示出来的性质是 (填编号)
A只有还原性 B还原性和酸性 C只有氧化性 D氧化性和酸性
(4)若有63.2g高锰酸钾参加反应,则被氧化的HCl的物质的量为 mol,产生的Cl2在标准状况下的体积为 L.
查看答案和解析>>
科目: 来源: 题型:
【题目】自然界为人类提供了多种多样的营养物质,下列有关营养物质的说法正确的是( )
A. 食用纤维素、蛋白质、脂肪和植物油都是高分子化合物
B. 棉花和蚕丝的主要成份都是纤维素
C. 麦芽糖、淀粉、纤维素都可以发生水解反应
D. 油脂都不能使溴水褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】硅及其化合物在材料领域中应用广泛。下列叙述正确的是( )
A.晶体硅可做光导纤维B.玻璃、水泥、陶瓷都是硅酸盐产品
C.SiO2可与水反应制备硅胶D.SiO2可做计算机芯片
查看答案和解析>>
科目: 来源: 题型:
【题目】现有14.4gCO和CO2的混合气体,在标准状况下所占的体积约为8.96L.回答下列问题:
(1)该混合气体中CO物质的量为mol;CO2物质的量为mol;
(2)混合气体中碳原子的个数;(用NA表示阿伏伽德罗常数的值)
(3)将混合气体依次通过如图装置,最后收集在气球中. ①气球中收集到的气体的摩尔质量;
②标况下气球中收集到的气体的体积为;
③气球中收集到的气体的电子总数为;(用NA表示阿伏伽德罗常数的值)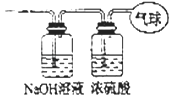
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题: 
(1)该“84消毒液”的物质的量浓度约为molL﹣1(小数点后保留一位).
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=molL﹣1 .
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为37.25%的消毒液.需要称量NaClO固体的质量为g
(4)配制上述“84消毒液”时,其正确的操作顺序是(每个操作只用一次): . A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在烧杯中加入适量水溶解
C.将烧杯中的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀,装入贴有标签的试剂瓶
E.改用胶头滴管加水,使溶液的凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
G.用天平称量该物质
(5)在溶液配制过程中,下列操作使溶液浓度偏小的是: .
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“84消毒液”而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线.
E.转移溶液时未洗涤烧杯.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.离子晶体中不含阴阳离子,只有溶液中才有阴阳离子
B.BF3分子的立体构型:三角锥形
C.非金属氧化物都是酸性氧化物
D.电解质溶液导电的过程就是电解质溶液被电解的过程
查看答案和解析>>
科目: 来源: 题型:
【题目】接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=190 kJ·mol1
2SO3(g) ΔH=190 kJ·mol1
(1)该反应所用的催化剂对反应正向移动的影响是________________(填“促进”“抑制”或“无影响”),该反应450℃时的平衡常数________500℃时的平衡常数(填“大于”“小于”或“等于”)。
(2)该热化学反应方程式的意义是________________________________。
(3)下列描述中能说明上述反应已达平衡的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=________mol·L1·min1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________移动(填“向正反应方向”“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com