
科目: 来源: 题型:
【题目】化学计量在化学中占有重要地位.根据计算填空:
(1)1.204×1022个NH3分子的物质的量为 , 在标准状况下的体积为mL.
(2)含0.4mol Fe3+的Fe2(S04)3中含SO42﹣的物质的量为 .
(3)已知8gX与10gY恰好完全反应生成0.02mol Z和15.88g W,则Z的摩尔质量为 .
(4)某混合溶液中只含有下列几种离子(不考虑水的电离):Na+、Mg2+、Cl﹣、SO42﹣ , 若Na+、Mg2+、Cl﹣的物质的量浓度依次为0.2mol/L、0.25mol/L、0.5mol/L,则(SO42﹣)= .
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列关于H2S和SO2的说法正确的是______________
A.两气体都可用浓硫酸干燥
B.两气体均可以用NaOH溶液吸收
C.两气体按体积比1:2 混合可完全转化为S
D.将两气体通入溴水或酸性KMnO4溶液中,可通过颜色变化鉴别两气体
(2)目前治理汽车尾气是在催化剂条件下发生反应2NO+2CO![]() N2+2CO2,现在实验室模拟上述反应,己知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
N2+2CO2,现在实验室模拟上述反应,己知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
①这段时间内CO的反应速率为_________________ 。
②该反应平衡常数______________(保留两位有效数字)。
③平衡后再向密闭容器通入0.4molCO和0.4molCO2,平衡将_____________(填“正向”、“逆向”或“不”)移动。判断理由是_________________。
④若升温发现体系气体平均相对分子质量增大,则该反应的△H______0(填“>”、“<”或“=”)。
⑤维持条件不变,向平衡后的容器再充入0.2molNO和0.1molCO,达到新平衡,则与原平衡相比NO的转化率____________ (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁加热至高温会分解,生成—种金属氧化物M和两种非金属氧化物。某化学研究小组利用下列装置加热至高温使FeSO4分解。
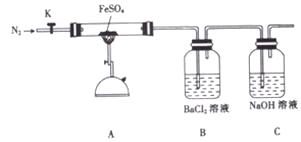
实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通入一段时间N2,关闭活塞K。加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却。
(1)已知M中铁元素的质量分数为70%,M的化学式为_____________。
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置进行实验。
操作步骤 | 实验现象 | 用方程式解释原因 |
打开K,通入一段时间N2,关闭K。加热A中玻璃管一段时间 | 洗气瓶B中①__________ | ②______________ |
A中固体不再分解后,停止加热,打开K,缓慢通入N2至玻璃管冷却 | 硬质玻璃管最终可以看到③_______________ | ④______________ |
(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N。
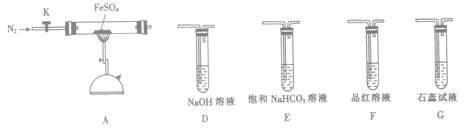
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→______→______。
②能证明生成了非金属氧化物N的现象是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A. 该溶液的pH=4
B. 升高温度,溶液的pH增大
C. 此酸的电离平衡常数约为1×10-7
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目: 来源: 题型:
【题目】氟是一种卤族元素。但它与其他卤素在单质和化合物的制备与性质上存在较明显的差异
(1)研究发现,SbF5能将MnF4从离子[MnF6]2-的盐中反应得到,SbF5转化成稳定离子[SbF6]-的盐。而MnF4很不稳定,受热易分解为MnF3和F2。根据以上研究写出以K2MnF6和SbF5为原料,在423 K的温度下制备F2的化学方程式:____________________。
(2)现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。
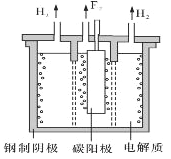
①已知KHF2是一种酸式盐,写出阴极上发生的电极反应式______________。
②电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是____________ 。
③HF的水溶液能用于蚀刻玻璃,其化学反应方程式为:_____________________。
④已知25℃时,氢氟酸(HF)的电离平衡常数Ka=3.6×10-4。某pH=2的氢氟酸溶液,由水电离出的c(H+)=_________mol/L;若将0.01 mol/L HF溶液与pH=12的NaOH溶液等体积混合,则溶液中离子浓度大小关系为:__________________。
⑤又已知25℃时,溶度积常数Ksp(CaF2)=1.46×10-10。现向1L0.2 mol/L HF溶液中加入1L0.2 mol/L CaCl2溶液,____________(填“是”、“否”) 有沉淀产生,并通过列式计算说明__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是
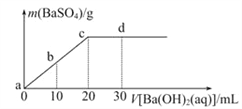
A. a~d溶液的pH:a<b<c<d
B. a~d溶液的导电能力:a<b<c<d
C. b处溶液的c(H+)与d处溶液的c (OH-)相等
D. c处溶液和d处溶液均呈碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学通过实验研究钠及其化合物的有关性质,请回答相关问题.
(1)实验室中少量的钠通常保存在 中,在实验室中取用钠的仪器是 .
(2)若将钠在空气中加热,钠会燃烧发出黄色火焰,同时生成 色的固体,写出该产物与H2O反应的化学方程式: .
(3)将金属钠投入水中,发生反应的离子方程式为
(4)该同学在实验室欲配制500mL0.1mol/L NaOH溶液. ①配制溶液时肯定不需要如图所示仪器中的(填字母),配制上述溶液还需要用到的玻璃仪器是(填仪器名称).
②根据计算,该同学应用托盘天平称取NaOH的质量为 .
③该同学将所配制的NaOH溶液进行测定,发现浓度大于0.1mol/L.下列操作会引起所配浓度偏大的是 .
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.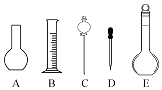
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 液态HCl不导电,所以HCl是非电解质
B. NH3、CO2的水溶液能导电,所以NH3、CO2是电解质
C. 铜、石墨均能导电,所以它们都是电解质
D. 蔗糖在水溶液中或熔融时均不导电,所以是非电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com