
科目: 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。
(4)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K______1.0(填“大于”“小于”或“等于”)。
(5)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____移动(填“向正反应方向”“向逆反应方向”或“不”)。
(6)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为__________(填“正反应方向”“逆反应方向”或“不移动”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6mol/L,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是
A. 1.2mol/(L·min)
B. 1.8mol/(L·min)
C. 0.02mol/(L·min)
D. 0.18mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. C2H4和C4H8一定是同系物
B. 氯乙烯和聚乙烯均能发生加成反应
C. C3H2Cl6有4种同分异构体
D. 等质量的乙烯和乙醇完全燃烧消耗氧气的量相同
查看答案和解析>>
科目: 来源: 题型:
【题目】在工业上常用CO和H2合成甲醇,反应方程式为:
CO(g)+2H2(g)![]() CH3OH(g) △H = akJ/mol
CH3OH(g) △H = akJ/mol
已知:①CO(g)+![]() O2(g)== CO2(g) △H1=﹣283.0kJ/mol
O2(g)== CO2(g) △H1=﹣283.0kJ/mol
②H2(g)+![]() O2(g)== H2O(g)△H2=﹣241.8kJ/mol
O2(g)== H2O(g)△H2=﹣241.8kJ/mol
③CH3OH(g)+![]() O2(g)== CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
O2(g)== CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
回答下列问题:
(1)a = _______
(2)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是___(填字母)。
CH3OH(g)已达平衡状态的是___(填字母)。
A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与![]() 的关系如图1所示.
的关系如图1所示.
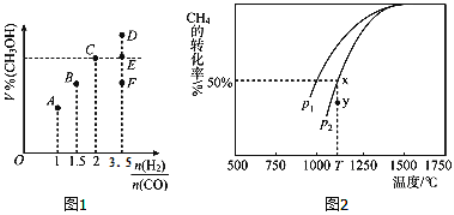
①当起始![]() =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
②当![]() = 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
= 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
(4)CO和H2来自于天然气。已知CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_______________p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______________v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_______________p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______________v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)含有甲醇的废水会造成环境污染,可通入ClO2气体将其氧化为CO2。写出相关反应的离子方程式_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】a、b、c、d、e、f分别是H、C、N、Na、Si、Cu六种元素中的其中一种,已知:图1表示的是六种元素单质的熔点高低顺序,其中c、d均是热和电的良导体,f形成的某种单质硬度最大。
回答下列问题:
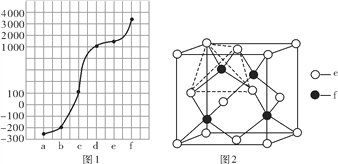
(1)a、b、f三种元素的电负性从小到大的顺序为________(用元素符号表示)。
(2)元素b的单质的一个分子中含有________个σ键和_________个π键。
(3)元素c的单质的晶体堆积方式类型是_______________________;若c单质分别与氟气和氯气形成化合物甲和乙,则甲的晶格能________乙的晶格能(填“>”“<”或“=”)。
(4)元素d的基态原子的价电子排布式为__________________。
(5)元素e和f可形成化合物丙(丙的晶胞结构如图2所示),则丙的化学式为_________;丙的晶体类型为_______________,在丙中,每个e原子周围最近的e原子数目为_____,若晶胞的边长为a pm,则丙的密度为____________g·cm-3(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子中,一定能够大量共存的是( )
A. Na+、HS-、Cl-、OH- B. Fe2+、Na+、Cl-、SO42-
C. K+、Fe3+、Ca2+、CO32- D. Mg2+、NH4+、Cl-、OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数为1-18号的元素中,下列叙述正确的是
A.I A族都是金属元素
B.II A族都是金属元素
C.最外层只有2个电子的元素一定是金属元素
D.核电荷数为17的元素的原子在化学反应中容易失去1个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. HCl溶于水后形成水合氢离子和水合氯离子
B. HCl溶于水或融熔状态下均能导电
C. 盐酸是电解质,酒精为非电解质
D. 盐酸属于无氧酸,H2SO4溶液属于含氧酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com