
科目: 来源: 题型:
【题目】下列关于细胞中化学元素的叙述,正确的是
A. 细胞中的脱氧核苷酸和脂肪酸都不含有氮元素
B. 细胞中一种元素的作用能被其他元素替代
C. 主动运输机制有助于维持细胞内元素组成的相对稳定
D. 细胞中的微量元素因含最极少而不如大量元素重要
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置可应用于实验室制氯气并回收二氯化锰的实验,能达到实验目的是( ) 
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离出MnCl2溶液中的固体MnO2
D.用装置丁称得回收的二氯化锰质量为5.36g
查看答案和解析>>
科目: 来源: 题型:
【题目】粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用①Na2CO3、②NaOH、③BaCl2、④HCl,加入的先后顺序不正确的是
A. ②③①④ B. ③②①④ C. ③①②④ D. ①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】I.甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84 kJ/mol 2H2(g)+O2(g)=2H2O(g) △H=-484 kJ/mol。工业上常以甲醇为原料制取甲醛,请写出 CH3OH (g)与O2 (g)反应生成HCHO(g)和H2O(g)的热化学方程式:_______________________。
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。该电池负极的电极反应式为________________。
Ⅱ.在2L密闭容器中,800℃时反应2NO(g)+O2 (g)![]() 2NO2 (g)体系中,n(NO)随时间的变化如表:
2NO2 (g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图所示,表示NO2变化曲线的是_______,用O2表示从0~2 s内该反应的平均速率v=_______。
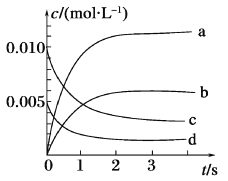
(2)能说明该反应已达到平衡状态的是_______(填序号)。
a.v(NO2) =2V(O2) b.容器内压强保持不变
c.体系颜色不再改变 d.容器内密度保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均能与A形成10电子分子,E单质可用于野外焊接钢轨的原料,F与D同主族。
(1)D、E、F的离子半径由大到小的顺序为___________(填离子符号)。
(2)写出能证明G比F非金属性强的一个化学方程式:_____________。
(3)F和G形成的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2:1:6,甲的电子式为_____,该反应的化学方程式为______________。
(4)C能分别与A和D按原子个数比1:2形成化合物乙和丙,乙的结构式为________。常温下,液体乙与气体丙反应生成两种无污染的物质,该反应的氧化产物与还原产物的物质的量之比为________。
(5)现取100 mL1 mol/L的E的氯化物溶液,向其中加入1 mol/L NaOH溶液产生了3.9 g沉淀,则加入的NaOH溶液体积可能为____mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】判断下列概念的依据正确的是
A. 纯净物与混合物:是否仅含有一种元素
B. 溶液与胶体:本质不同的原因是能否发生丁达尔现象
C. 强弱电解质:溶液的导电能力大小
D. 氧化还原反应的本质:有无电子转移
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:氮气和氢气合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92kJ/mol。请回答下列问题:
2NH3(g) ΔH=-92kJ/mol。请回答下列问题:
(1)取1 mol N2(g)和3 molH2(g)充入一密闭容器中,一定条件下进行反应并达平衡时,测得反应放出的热量____92kJ(填“大于”、“等于”或“小于”);若升高温度,上述反应中ΔH____(填“变大”、“变小”或“不变”)。
(2)已知:分别破坏1molN![]() H键、1mol H
H键、1mol H![]() H键需要吸收的能量为:391 kJ、436 kJ,则破坏1mol N
H键需要吸收的能量为:391 kJ、436 kJ,则破坏1mol N![]() N键需要吸收的能量为___________。
N键需要吸收的能量为___________。
(3)一定条件下,向体积为2L的恒容密闭容器中充入1molNH3(g)并发生上述反应。半分钟后反应达到平衡,测得v(NH3)=0.40mol/(Lmin),则N2(g)+3H2(g)![]() 2NH3(g)反应的平衡常数为___________。
2NH3(g)反应的平衡常数为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
I. CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
II. 2CH3OH(g)===CH3OCH3(g)+H2O(g)
(1)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为______反应(填”吸热”’或”放热”)。
(2)在恒容密闭容器中发生反应I:
①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是____(填“a”或“b”)。
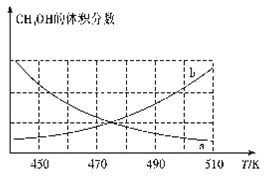
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(3)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3) ,则:
①0~4min,反应I的v(H2)=______,反应I的平衡常数K=______。
②反应II中CH3OH的转化率α=_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】磁性材料A由两种元素组成,取2.960 g A在足量的空气中充分煅烧,得到2.400 g红棕色固体B和无色刺激性气体D。固体B溶于盐酸形成棕黄色溶液C,再加入KSCN溶液变为血红色。气体D溶于水得到无色酸性溶液E,向E中加足量碘的碘化钾溶液(红棕色)得到溶液F,同时溶液酸性增强。请回答下列问题:
(1)溶液C也可用于处理污水,用离子方程式表示污水处理原理:_______________。
(2)已知化合物A能与稀硫酸反应,反应后得到浅绿色溶液,同时生成一种淡黄色不溶物和一种臭鸡蛋气味气体,写出该反应的化学方程式:_______________。
(3)用离子方程式解释E中加足量碘的碘化钾溶液后溶液酸性增强的原因_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com