
科目: 来源: 题型:
【题目】关于苯的硝化反应,下列说法不正确的是( )
A.浓硫酸起了催化剂、吸水剂的作用
B.加热50-60℃通常通过水浴来实现
C.由于苯和硝酸都易挥发,所以通常需要加冷凝装置
D.纯净的硝基苯为深黄色比水重的液体
查看答案和解析>>
科目: 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是
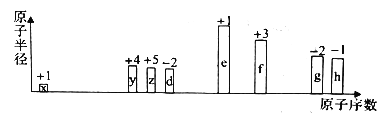
A. 离子半径的大小顺序:d
B. 与x形成简单化合物的沸点:y>z>d
C. 除去实验后试管中残留的g单质,可用热的氢氧化钠溶液
D. g、h的氧化物对应的水化物的酸性:h>g
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列反应的离子方程式。
(1)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒里盛碳酸氢钠溶液,其化学反应的原理是________________________。
(2)对于易溶于水的正盐MnRm溶液,若pH>7,其原因是___________________。
(3)在25℃下,向0.1 L 0.002 molL1 的NaCl溶液中逐滴加入0.1 L 0.002 molL1硝酸银溶液,有白色沉淀生成向反应后的浊液中继续加入0.1 L0.002 molL1的NaI溶液,看到白色沉淀转化为黄色沉淀,产生该现象的原因用是_______________________________________。(已知:25℃时Ksp(AgCl)=1.6×10-10,Ksp(AgI)=1.5×10-16)
(4)向盛有少量草酸溶液的试管中滴加几滴酸性KMnO4溶液,震荡,溶液紫色褪去的原因是_____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温下若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是__________。
A.若混合后溶液呈中性:c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(2)常温下,浓度均为0.1 mol/L的下列五种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是__________。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是________。
A.CH3COOH + Na2CO3 ==NaHCO3 + CH3COONa
B.CH3COOH + NaCN ==CH3COONa+ HCN
C.CO2 + H2O+ 2 NaClO ==Na2CO3+2 HClO
D.NaHCO3 + HCN == NaCN+ H2O+ CO2↑
(3)将氨气溶于水得到氨水,是一种弱碱。常温下,现将amol/L氨水和0.01mol/L盐酸等体积混合后,溶液中c(NH4+)=c(Cl-),则氨水的Kb= ____________。(用含a的代数式表示)
(4)25℃,用0.1000 mol / LNaOH溶液滴定20.00mL0.1000mol/L某一元酸HA溶液所得滴定曲线如图。

①为减小实验误差,由图可知滴定时指示剂应选用__________ (填“石蕊”、“酚酞”、“甲基橙”);
②A、B、C三点所示溶液导电能力最强的是_________点对应的溶液;
③比较A、C两点中水的电离程度:A ______ C(填“>”、“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验能够成功的是
A. 用托盘天平量取10.88克碳酸钠
B. 用在氧气中加热的方法除去过氧化钠中的氧化钠
C. 用稀盐酸除去碳酸钠溶液中的碳酸氢钠
D. 用四氯化碳保存金属钠
查看答案和解析>>
科目: 来源: 题型:
【题目】现有含NaCL、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现CL﹣、SO42﹣、和NO3﹣的相互分离.相应的实验过程可用下图表示: 
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X: , 沉淀A: , 沉淀B: .
(2)上述实验流程中加入过量的Na2CO3的目的是 .
(3)按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的 , 之后若要获得固体NaNO3需进行的实验操作是(填操作名称).
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH。
CH3OH(g) ΔH。
(1)能判断反应达到平衡状态的依据是__________(填字母序号)。
A.2 ν逆(H2) = ν 正(CO)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
F、CO、H2、CH3OH的速率之比为1:2:1
(2)CO在不同温度下的平衡转化率与压强的关系如图1,该反应△H_______0(填“>”或“<”)。

(3)一定温度下,将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则:
①该反应的平衡常数为_______________。
②若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是_______________(“正向移动”“逆向移动”或“不移动”);
③在其他条件不变的情况下,将容器体积压缩到原来的![]() ,与原平衡相比,下列有关说法正确的是_____________(填字母)。
,与原平衡相比,下列有关说法正确的是_____________(填字母)。
A.H2的浓度减小; B.正反应速率加快,逆反应速率也加快;
C.甲醇的物质的量增加; D.重新平衡时, ![]() 增大;
增大;
(4)上图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A_________ C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A_________ C,由状态B到状态A,可采用_____________的方法(填“升温”或“降温”)。
(5)如图是一定的温度和压强下![]() 和
和![]() 反应生成1 mol
反应生成1 mol ![]() 过程中能量变化示意图,请写出工业合成氨的热化学方程式__________________
过程中能量变化示意图,请写出工业合成氨的热化学方程式__________________![]() H的数值用含字母
H的数值用含字母![]() 、Q
、Q![]() 的代数式表示)。
的代数式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】构成细胞的化学元素没有一种是生命物质所特有的这个事实说明
A. 生物体是由无机物组成的
B. 生物与非生物完全相同
C. 生物界与非生物界具有统一性
D. 生物与非生物完全不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com