
【题目】写出下列反应的离子方程式。
(1)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒里盛碳酸氢钠溶液,其化学反应的原理是________________________。
(2)对于易溶于水的正盐MnRm溶液,若pH>7,其原因是___________________。
(3)在25℃下,向0.1 L 0.002 molL1 的NaCl溶液中逐滴加入0.1 L 0.002 molL1硝酸银溶液,有白色沉淀生成向反应后的浊液中继续加入0.1 L0.002 molL1的NaI溶液,看到白色沉淀转化为黄色沉淀,产生该现象的原因用是_______________________________________。(已知:25℃时Ksp(AgCl)=1.6×10-10,Ksp(AgI)=1.5×10-16)
(4)向盛有少量草酸溶液的试管中滴加几滴酸性KMnO4溶液,震荡,溶液紫色褪去的原因是_____________________________________________________________。
【答案】 Al3+ + 3HCO3- = Al(OH)3 ↓+3CO2↑ Rn- + H2O![]() HR(n-1) -+ OH- AgCl(s)+ I- (aq)
HR(n-1) -+ OH- AgCl(s)+ I- (aq)![]() AgI(s)+ Cl - (aq) 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
AgI(s)+ Cl - (aq) 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
【解析】(1). Al3+与HCO3发生互相促进的双水解反应,反应式为Al3++3HCO3═Al(OH)3↓+3CO2↑,产生大量二氧化碳气体,可用于灭火,故答案为:Al3++3HCO3═Al(OH)3↓+3CO2↑。
(2).由于酸根离子的水解(以第一步为主),结合由水电离出来的氢离子,生成弱酸,促进了水的进一步电离,而使氢氧根离子增加,使pH>7,故答案是:Rn-+H2OHR(n-1)-+OH-。
(3).由于KSP(AgCl)>KSP(AgI),则AgCl会转化为AgI,白色沉淀转化为黄色沉淀,反应的离子反应为:AgCl(s)+I-(aq)=AgI(s)+Cl-(aq),
故答案为:AgCl(s)+I-(aq)=AgI (s)+Cl-(aq)。
(4).酸性KMnO4溶液具有强氧化性,向盛有少量草酸溶液的试管中滴加几滴酸性KMnO4溶液,,振荡,发现其溶液的紫色褪去,说明草酸被酸性高锰酸钾氧化。根据氧化还原反应方程式的配平原则:得失电子守恒、质量守恒和电荷守恒配平该反应的离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入适量的
A.CaCO3(s) B.Na2SO4溶液
C.KNO3溶液 D.CuSO4(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)Cu+在基态时的价电子排布式为______。
(2)砷、碲是第四周期的相邻元素,已知砷的第一电离能大于硒。请从原子结构的角度加以解释______。
(3)GaAs熔点1238℃,难溶于溶剂。其晶体类型为_________。
(4)AsF3的空间构型是:______________。
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为______。
②[B(OH)4]-的结构式为____________。
(6)金刚石的晶胞如下图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅:若将金刚石晶体中一半的碳原子換成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
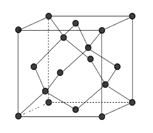
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是_______(用化学式表示)。
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼的密度是___________g·㎝-3(B的相对原子质量为11,只要求列算式,不必计算出数值,阿伏伽徳罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯
己知: 

密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环乙醇 | 0.96 | 25 | 161 | 能溶于水 |
环乙烯 | 0.81 | -103 | 83 | 难溶于水 |
(1) 制备粗品将12.5 mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________②试管C置于冰水浴中的目的是______________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环乙烯在______层(填上或下),分液后用___________(填入编号)洗涤。
a. KMnO4溶液 b.稀 H2SO4 c. Na2CO3溶液
②再将环己烯按图2所示装置蒸馏,冷却水从________口进入,收集产品时,控制的温度应在______左右。
(3)以下区分环己烯精品和租品的方法,合理的是_____________。
a.用酸性高锰酸钾溶液 b.用NaOH溶液 c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3性质的说法不正确的是
A.热稳定性:NaHCO3<Na2CO3
B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3
C. 相同温度时,在水中的溶解性:NaHCO3<Na2CO3
D. 等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g) △H<0,达到平衡时,下列说法正确的是
CO(NH2)2(s)+H2O(g) △H<0,达到平衡时,下列说法正确的是
A. 加入催化剂,平衡常数不变
B. 减小容器体积,正反应速率增大、逆反应速率减小
C. 增大CO(NH2)2的量, CO2的转化率减小
D. 降低温度,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol 化学键所需的能量(kJ):N≡N为942、O=O为500、N―N 为154,则断裂1 mol N―H 键所需的能量(kJ)是

A.194 B.391 C.516 D.658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用氨碱法制取碳酸钠,却不能用氨碱法制碳酸钾,这是因为在溶液中( )
A. KHCO3溶解度较大 B. KHCO3溶解度较小 C. K2CO3溶解度较大 D. K2CO3溶解度较小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com