
【题目】肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol 化学键所需的能量(kJ):N≡N为942、O=O为500、N―N 为154,则断裂1 mol N―H 键所需的能量(kJ)是

A.194 B.391 C.516 D.658
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K 是无色气体,是主要的大气污染物之一。0.05 mol/L丙溶液的pH为1,上述物质的转化关系如图所示。下列说法正确的是
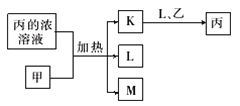
A. K、L、M 中沸点最高的是M
B. 元素的非金属性:Z>Y>X
C. 原子半径:W<X<Y
D. 丙也可由W、Y组成的某化合物与K直接反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式。
(1)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒里盛碳酸氢钠溶液,其化学反应的原理是________________________。
(2)对于易溶于水的正盐MnRm溶液,若pH>7,其原因是___________________。
(3)在25℃下,向0.1 L 0.002 molL1 的NaCl溶液中逐滴加入0.1 L 0.002 molL1硝酸银溶液,有白色沉淀生成向反应后的浊液中继续加入0.1 L0.002 molL1的NaI溶液,看到白色沉淀转化为黄色沉淀,产生该现象的原因用是_______________________________________。(已知:25℃时Ksp(AgCl)=1.6×10-10,Ksp(AgI)=1.5×10-16)
(4)向盛有少量草酸溶液的试管中滴加几滴酸性KMnO4溶液,震荡,溶液紫色褪去的原因是_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按下列要求填空
I. (1)乙炔的电子式_______________
(2)高聚物![]() 其单体的结构简式为_______________
其单体的结构简式为_______________
(3)  的名称(系统命名法)_____________
的名称(系统命名法)_____________
II.某芳香族化合物的分子式为C7H8O
(4)根据下列实验现象确定其结构简式(要求:每小题只需给出一个答案即可)
①不能与金属钠反应,其结构简式__________________。
②能与钠反应,但遇FeCl3不显色_________________。
③能与钠反应且遇FeCl3显紫色____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如图)。下列说法正确的是

A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图4所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_____________。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________。
(4)丙组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是______________________
(5)丁组同学利用下列各图方案制备Fe(OH)2能较长时间看到Fe(OH)2白色沉淀的是________(填序号)。


(6)戊组同学为了检验硫酸铁中含有的Fe2+应选用________(选填序号)并写出离子方程式______________
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是实验操作中,能达到实验目的是( )
A. 用1000mL量筒量取5.2mL盐酸
B. 用电子天平称取25.2250g氯化钠
C. 用100mL容量瓶配制50mL 0.1mol·L-1盐酸
D. 用25.00mL红柄滴定管量取14.80mL NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
I.CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
II.2CH3OH(g)===CH3OCH3(g)+H2O(g)
(1)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为_______反应(填“吸热”或“放热”)。
(2)在恒容密闭容器中发生反应I:
①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是______________(填“a”或“b”)。

②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(3)500K时,在2L密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3) ,则:
① 0~4 min,反应I的v(H2)=______,反应I的平衡常数K=______。
② 反应II中CH3OH的转化率α=_______。

(4)二甲醚燃料电池的工作原理如图听示,则X电极的电极反应式为_______。用该电池对铁制品镀铜,当铁制品质量增加64 g时,理论上消耗二甲醚的质量为_______g(精确到0.01)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com