
科目: 来源: 题型:
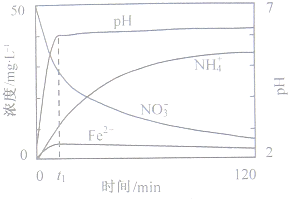 (2011?安徽)地下水中硝酸盐造成的氮污染已成为一个世界性的环节问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.
(2011?安徽)地下水中硝酸盐造成的氮污染已成为一个世界性的环节问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.查看答案和解析>>
科目: 来源: 题型:
 (2011?安徽)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
(2011?安徽)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
(2011?安徽)下列有关实验操作、现象和解释或结论都正确的是( )
|
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| ⅢA | ⅦA | ||||||||||||||||
| ① | ② | ③ | |||||||||||||||
| ④ | ⅢB | ⅦB | ⅡB | ⑤ | ⑥ | ⑦ | ⑧ | ||||||||||
| ⑨ | Fe | ⑩ | |||||||||||||||
| E | |||||||||||||||||


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com