
科目: 来源: 题型:
【题目】不用其他试剂,只用试管和胶头滴管无法鉴别的是( )
A.Al2(SO4)3和NaOH
B.Na2CO3和盐酸
C.NaCl和AgNO3
D.盐酸、NaAlO2
查看答案和解析>>
科目: 来源: 题型:
【题目】Cl2用来消毒生活用水的原因是
A.Cl2能杀灭细菌
B.Cl2有毒
C.Cl2是氧化性很强的气体
D.Cl2与水反应生成HClO有强氧化性,可杀灭水中细菌
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 硅酸可由二氧化硅与水反应制得
B. Na2SiO3是硅酸盐,但不能溶于水
C. 硅是非金属元素,它的单质是灰黑色有金属光泽的固体
D. 硅是制造光导纤维的材料
查看答案和解析>>
科目: 来源: 题型:
【题目】Mg﹣H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( ) 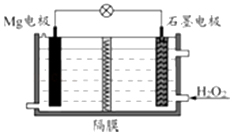
A.Mg 电极是该电池的正极
B.H2O2在石墨电极上发生还原反应
C.石墨电极附近溶液的pH 减小
D.溶液中Cl﹣向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:a.C2H2(g)+ H2(g)= C2H4(g)ΔH<0
b. 2CH4(g)= C2H4(g)+ 2H2(g)ΔH>0
判断以下3个热化学方程式:
①C(s)+ 2H2(g)= CH4(g)ΔH1
②C(s)+ ![]() H2(g)=
H2(g)= ![]() C2H2(g)ΔH2
C2H2(g)ΔH2
③C(s)+ H2(g)= ![]() C2H4(g)ΔH3
C2H4(g)ΔH3
ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A. ΔH2 >ΔH3 >ΔH1 B. ΔH3 >ΔH2 >ΔH1
C. ΔH3 >ΔH1 >ΔH2 D. ΔH1 >ΔH2 >ΔH3
查看答案和解析>>
科目: 来源: 题型:
【题目】对危险化学品要在包装上印有警示性标志,下列化学品的名称与警示性标志名称对应正确的是
A. 烧碱---爆炸品 B. 浓硫酸---剧毒品 C. 汽油---腐蚀品 D. 酒精---易燃品
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( ) 
A.该反应的化学方程式为3B+2D6A+4C
B.反应进行到1 s时,v(A)=3v(D)
C.反应进行到6 s时,B的平均反应速率为0.05mol/(Ls)
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、碳都是重要的非金属元素,合理应用和处理碳和氮的化合物,在生产生活中有重要意义。
I.研究含氮污染物的治理是环保的一项重要工作。
T℃时,发生如下反应,3NO(g)+O3(g)![]() 3NO2(g),将0.6molNO和0.2molO3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图1所示。
3NO2(g),将0.6molNO和0.2molO3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图1所示。
①T℃时,反应3NO(g)+O3(g)![]() 3NO2(g)的平衡常数K=_____。
3NO2(g)的平衡常数K=_____。
②不能说明反应达到平衡状态的是______________。
A.气体颜色不再改变 B.气体的平均摩尔质量不再改变
C.气体的密度不再改变 D.单位时间内生成O3和NO2物质的量之比为1∶3

II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题。如图2所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为aL(忽略导管中的气体体积)。
①若容器A中到达平衡所需时间ts,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)=_______。
②若打开K2,平衡后B容器的体积缩至0.4aL,则打开K2之前,气球B体积为__________L。
③若平衡后在A容器中再充入0.5molN2O4,则重新到达平衡后,平衡混合气中NO2的体积分数____(填“变大”“变小”或“不变”)。
Ⅲ.氮有不同价态的氧化物,如NO、N2O3、NO2等,它们在一定条件下可以相互转化。
(1)某温度下,在一体积可变的密闭容器中充入1mol N2O3,发生反应N2O3![]() NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图像如图所示,有关说法正确的是__________
NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图像如图所示,有关说法正确的是__________

A.t1时刻改变的条件是增大N2O3的浓度,同时减小NO2或NO的浓度
B.t1时刻改变条件后,平衡向正反应方向移动,N2O3的转化率增大
C.在t2时刻达到新的平衡后,NO2的百分含量不变
D.若t1时刻将容器的体积缩小至原容积的一半,则速率~时间图像与上图相同
(2)在1000K下,在某恒容容器中发生下列反应:2NO2(g)![]() 2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。图中a点对应温度下.己知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。图中a点对应温度下.己知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。


(3)对于反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中,k1、2是与反应及温度有关的常数。相应的速率-压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的两个点__________,理由是__________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中,k1、2是与反应及温度有关的常数。相应的速率-压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的两个点__________,理由是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】兔耳草醛H是一种重要的香料,主要用于食品、化妆品等工业中。用有机物A为原料可以合成兔耳草醛H,其合成路线如图所示,其中有机物A的核磁共振氢谱只有一组峰:

中间产物D是一种精细化工产品,可用作香料,能发生如下反应:

已知:I.醛与二元醇(如乙二醇)可发生以下反应: ![]()
Ⅱ. ![]()
请回答:
(1)D的结构简式为________,E中含有的官能团名称为_________。
(2)A与反应物a在AlCl3催化下得到B,该反应源于工业制乙苯,则反应物a为__________(写出结构简式),该反应的反应类型为________________________
(3)由C到D需要两步反应,请依次写出反应条件_____________________________
(4)F→G的反应类型___________, G→H的化学方程式为____________________________。
(5)兔耳草醛H中的含氧官能团易被氧化,生成化合物W,G与W可发生酯化反应,写出G与W反应的化学方程式_____________________________________________。
(6)写出与W互为同分异构体且符合下列条件所有同分异构体的结构简式________
a.属于芳香族化合物且苯环上有三个取代基
b.1 mol该物质最多可消耗2molNaOH
c.能发生银镜反应
d.核磁共振氢谱有5组峰(面积为12:2:1:2:1)
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列操作中,可得到纯净氧化铝的是( )
A.向氯化铝溶液中加入过量氨水后,蒸干并灼烧
B.向偏铝酸钠溶液中加入适量AlCl3溶液,蒸干并灼烧
C.向偏铝酸钠溶液中通入过量CO2后,蒸干并灼烧
D.向偏铝酸钠溶液中加入适量硫酸后,蒸干并灼烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com