
科目: 来源: 题型:
【题目】下面对硝酸的认识不正确的是( )
A. 浓硝酸和稀硝酸都具有氧化性B. 铜与稀硝酸的反应属于置换反应
C. 金属与硝酸反应一定不产生氢气D. 可用铁或铝制品盛装浓硝酸
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
(1)该浓硫酸中H2SO4的物质的量浓度为 mol/L.
(2)取用任意体积的该硫酸溶液时,下列物理量中不随所取硫酸分子式:H2SO4相对分子量:98密度1.2g/mLH2SO4多少而变化的是 .
A.溶液中H2SO4的物质的量
B.溶液的浓度
C.溶液中H+的数目
D.溶液的密度
(3)某学生欲用上述浓硫酸和蒸馏水配制500mL物质的量浓度为0.3mol/L硫酸.
①该学生需要量取 mL上述浓硫酸进行配制.
②配制过程中,需要使用的仪器是(填写代号) .
A.烧杯 B.量筒 C.1000mL容量瓶 D.托盘天平
E.药匙 F.500mL容量瓶 G.胶头滴管 H.玻璃棒
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次);
A.用30mL水洗涤烧杯2﹣3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓硫酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的硫酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1﹣2cm处
④在配制过程中,下列实验操作会使所配制的稀硫酸的物质的量浓度偏高的是 .
A.用量筒量取浓硫酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配置前用已知浓度的稀硫酸润洗容量瓶.
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题.
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ⑨ | |||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ |
(1)化学性质最不活泼的元素是(填元素符号),其原子结构示意图为 .
(2)元素⑧的名称为,其最高价氧化物的水化物的化学式为 .
(3)元素③与元素⑧形成化合物的电子式为 .
(4)非金属性最强的元素是(填元素符号).除0族外原子半径最大的元素是(填元素符号).元素①单质与水反应的离子方程式是 .
(5)①、③、⑤三种元素的最高价氧化物水化物中,碱性最强的化合物的化学式是 .
(6)能形成两性氢氧化物的元素是(用元素符号表示),写出该元素的单质与①的最高价氧化物的水化物反应的化学方程式
查看答案和解析>>
科目: 来源: 题型:
【题目】一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物 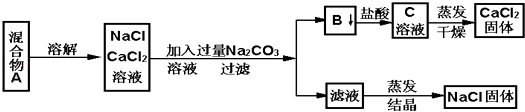 填空和回答下列问题
填空和回答下列问题
(1)B物质是(写化学式)
(2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中某一步设计有毛病,这一步的正确设计方案应是 .
(3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】配平下列氧化还原方程式,并完成以下问题.
(1) Br2+NaI═ NaBr+I2 , 该反应中氧化产物是 .
(2) Fe+H2SO4(浓) ![]() Fe2(SO4)3+SO2↑+H2O
Fe2(SO4)3+SO2↑+H2O
此反应中,氧化剂是 , 所得还原产物为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】钡与钠相似,也能形成含O22﹣的过氧化物,下列叙述中正确的是( )
A.过氧化钡的化学式为Ba2O2
B.O22﹣的电子式为: ![]()
C.反应Na2O2+2HCl═2NaCl+H2O2为氧化还原反应
D.过氧化钡和过氧化钠都具有强氧化性
查看答案和解析>>
科目: 来源: 题型:
【题目】进行下列化学基本量的计算,并将结果直接填入空格中.
(1)0.1molH2SO4约含H原子的个数为个,溶于水后电离出SO42﹣的物质的量为mol.
(2)36g水与g CO2具有相同的氧原子数.
(3)71gNa2SO4中所含Na+的物质的量为mol.
(4)同温同压下的氧气和氢气,若体积相同时,两种气体的质量比为 , 其密度比为;若质量相等时,两种气体的体积比 .
查看答案和解析>>
科目: 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K= ![]() .恒容时,温度升高,H2浓度减小.下列说法正确的是( )
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2OCO2+H2
查看答案和解析>>
科目: 来源: 题型:
【题目】向胶体中加入电解质,能使胶体凝聚。使一定量的胶体在一定时间内开始凝聚所需电解质的浓度(mol·L1)称作“聚沉值”。电解质的聚沉值越小,则表示其凝聚能力越大,实验证明,凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越多,凝聚力越大。已知Fe(OH)3胶粒带正电,则向Fe(OH)3胶体中加入下列电解质时,其“聚沉值”最小的为
A.NaCl B.FeCl3
C.K2SO4 D.Na3PO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com