
科目: 来源: 题型:
【题目】将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式 .
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是 .
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为 , 制得的气体可用如图所示装置收集,则气体应从(填“A”或“B”)通入.
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为 , 若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为、、 .
(5)取一定量的X晶体分解,若生成F 1mol,则必同时生成物质mol. 
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组对一含有Al3+的未知溶液进行了如下分析: ①滴入少量氢氧化钠,无明显变化;
②继续滴加NaOH溶液,有白色沉淀;
③滴入过量的氢氧化钠,白色沉淀明显减少.实验小组经定量分析,得出如图所示沉淀与滴入氢氧化钠体积的关系.下列说法错误的是( )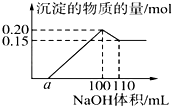
A.该未知溶液中至少含有3种阳离子
B.滴加的NaOH溶液的物质的量浓度为5 molL﹣1
C.若另一种离子为二价阳离子,则a=10
D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将0.05mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质.有关结论正确的是( )
加入的物质 | 结论 | |
A | 50mL 1mol/L H2SO4 | 反应结束后,c(Na+)=c(SO42﹣) |
B | 0.5mol CaO | 溶液中 |
C | 50mL H2O | 由水电离出的c(H+)c(OH﹣)不变 |
D | 0.1mol NaHSO4固体 | 反应完全后,溶液pH减小,c (Na+)不变 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种高效绿色水处理剂,其工业制备的反应原理为:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O,下列说法正确的是( )
A.制高铁酸钾用 KClO做还原剂
B.Fe(OH)3是还原剂
C.高铁酸钾中铁的化合价为+7
D.制备高铁酸钾时1 molFe(OH)3得到3 mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H﹣H键能为436kJmol﹣1 , N﹣H键能为391kJmol﹣1 , 根据化学方程式:N2(g)+3H2(g) ![]() 2NH3(g)△H=﹣92.4kJmol﹣1 , 则N≡N键的键能是( )
2NH3(g)△H=﹣92.4kJmol﹣1 , 则N≡N键的键能是( )
A.431 kJmol﹣1
B.946 kJmol﹣1
C.649 kJmol﹣1
D.896 kJmol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列除杂或鉴别的方法不可行的是
A.用Br2水可鉴别苯与乙醇
B.将混合气体通过灼热的铜网除去N2中的少量O2
C.用KMnO4溶液除去乙烯中的乙炔
D.用适量HNO3除去NaNO3溶液中少量的Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)= . 由水电离出的c(H+)= .
(2)已知MgA2是难溶电解质,则其溶解平衡时的Ksp(MgA2)=;
(3)pH=3的盐酸和pH=3的HA溶液各稀释至其体积的100倍,稀释后盐酸的pH(填“大于”、“小于”或“等于”)HA溶液的pH;
(4)NaA的水溶液显性,原因是(用离子方程式表示).
(5)欲测定某NaOH溶液的物质的量浓度,可用0.1000molL﹣1HA标准溶液进行中和滴定(用酚酞作指示剂).滴定至终点的颜色变化为 . 下列哪些操作会使测定结果偏高(填序号).
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com