
科目: 来源: 题型:
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
(1)向一定物质的量浓度的Cu(NO3)2 和Mn(NO3)2 溶液中加入Na2CO3 溶液,所得沉淀经高温灼烧,可制得CuMn2O4 . ①Mn2+基态的电子排布式可表示为 .
②NO3﹣的空间构型是(用文字描述).
(2)在铜锰氧化物的催化下,CO 被氧化为CO2 , HCHO 被氧化为CO2 和H2O. ①根据等电子体原理,CO 分子的结构式为 .
②H2O 分子中O 原子轨道的杂化类型为 .
③1mol CO2 中含有的σ键数目为 .
(3)向CuSO4 溶液中加入过量NaOH 溶液可生成[Cu(OH)4]2﹣ . 不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为 .
(4)如图1为三种不同晶体的晶胞结构图: 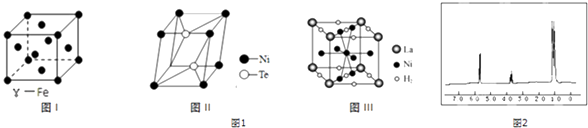
①图I γ﹣Fe结构中每个铁原子周围距离最近且相等的铁原子数目为 .
②图II是元素Ni的一种碲(Te)化物晶体的晶胞结构,则该化合物的化学式为 .
③图III是一种镍基合金储氢后的晶胞结构示意图.该合金储氢后,含1mol La的合金可吸附H2的数目为 .
(5)已知1﹣丙醇和2﹣丙醇的结构简式如下: 1﹣丙醇:CH3﹣CH2﹣CH2﹣OH
2﹣丙醇: ![]()
图2是这两种物质的其中一种的核磁共振谱,并且峰面积比分别为1:1:6,请指出具有该核磁共振氢谱的物质是(写名称)
查看答案和解析>>
科目: 来源: 题型:
【题目】用物理方法从植物体中提取,或是用化学方法合成药用化学物质,治疗病症,挽救性命,一直是科学家们致力研究的课题.请用化学知识分析“青蒿素”、“华法林”两种药物的结构及合成过程.
(1)2015年诺贝尔医学奖授予中国女药学家屠呦呦.“因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.” 
下列关于青蒿素和双氢青蒿素(结构如图1所示)的说法错误的是 .
A.青蒿素分子中含有过氧键、酯基和醚键
B.青蒿素的分子式为C15H22O5
C.由双氢青蒿素转化为青蒿素的反应属氧化反应
D.双氢青蒿素分子中有2个六元环和2个七元环
(2)华法林是一种治疗心脑血管疾病的药物,其合成路径如图2(部分反应条件略去). 
已知:①![]()
②
(I)A属于芳香烃,名称是;
(II)C生成D的反应类型是; E与N合成华法林的反应类型是 .
(III)B→C的转化过程中的化学反应方程式为;
(IV)E的结构简式是 . L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为 .
(V)K有多种同分异构体,满足下列条件的K的同分异构体还有种.
①属于芳香族化合物 ②遇到FeCl3显紫色 ③可发生水解反应.
写出其中满足核磁共振氢谱图显示峰值比为1:2:2:2:1的同分异构体的结构简式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】X+的核外电子数分别为2、8、8,则X元素在周期表中的位置是( )
A. 第三周期第0族 B. 第四周期第ⅠA族
C. 第三周期第ⅠA族 D. 第三周期第ⅦA族
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:
(1)A,B,C三种元素的第一电离能由小到大的顺序是(用元素符号表示).
(2)B与C能形成四原子阴离子,其中B的杂化方式为;B的三氯化物分子的立体构型为 .
(3)任写一种与AB﹣离子互为等电子体的离子(写化学式).
(4)F原子的外围电子排布式为 , F晶体的堆积方式为(填序号:①简单立方堆积,②体心立方堆积,③六方最密堆积,④面心立方密集堆积).
(5)E的离子可以形成多种配合物,将ECl3溶液蒸发浓缩,析出深绿色晶体.该晶体中E3+、Cl﹣、H2O的物质的量之比为1:3:6,且E的配位数为6,向1.0mol该晶体的溶液中加入足量AgNO3溶液产生143.5g沉淀,则配合物的化学式为 .
(6)硼与D可形成一种耐磨材料,其结构与金刚石相似,如图为其晶体结构单元,它可由硼的三溴化物和D的三溴化物于高温下在氢气的氛围中合成
①写出合成该晶体的化学方程式: .
②已知晶体中硼与D原子的最近距离为a pm,则该晶体密度的表达式为gcm﹣3 .
(不需化简,阿伏伽德罗常数为NA)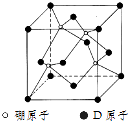
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述错误的是
A.可用铝制容器盛装稀硫酸
B.Na2O2可用于呼吸面具中作为氧气的来源
C.Fe2O3常用于制造红色油漆和涂料
D.Si可用于制造太阳能电池
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于元素周期表的叙述中不正确的是( )
A. 元素种类最多的族是第Ⅷ族
B. 第ⅠA族金属元素单质均能与水反应
C. 第ⅡA族中无非金属元素
D. 金属元素的种类比非金属元素多
查看答案和解析>>
科目: 来源: 题型:
【题目】开发清洁能源是当今研究的热点问题.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3 . 工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)CH3OH(g)△H1=﹣99kJmol﹣1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=﹣23.5kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=﹣41.2kJmol﹣1
(1)催化反应室中的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),计算△H= . 反应原料来自煤的气化.已知该反应的平衡常数表达式为K= ![]() ,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式 .
,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式 .
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6molL﹣1 , c(H2)=1.4molL﹣1 , 8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为 .
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(molL﹣1) | 0.46 | 1.0 | 1.0 |
此时刻v正v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是 .
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图1所示,图中X代表(填“温度”或“压强”)判断的理由是 
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比 ![]() 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因:
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因:
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组同学对由NaHCO3和KHCO3组成的某均匀混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
试计算:
(1)混合物与盐酸反应的离子方程式;
(2)盐酸的物质的量浓度 ;
(3)混合物中两物质的物质的量之比 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.通常所说的三大合成材料是指塑料、合成纤维、合成橡胶
B.塑料的主要成分是合成树脂,另外还含有一些添加剂
C.用木材等经过加工制成的黏胶纤维属于合成纤维
D.合成橡胶的原料是煤、石油、天然气和农副产品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com