
【题目】开发清洁能源是当今研究的热点问题.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3 . 工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)CH3OH(g)△H1=﹣99kJmol﹣1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=﹣23.5kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=﹣41.2kJmol﹣1
(1)催化反应室中的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),计算△H= . 反应原料来自煤的气化.已知该反应的平衡常数表达式为K= ![]() ,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式 .
,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式 .
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6molL﹣1 , c(H2)=1.4molL﹣1 , 8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为 .
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(molL﹣1) | 0.46 | 1.0 | 1.0 |
此时刻v正v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是 .
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图1所示,图中X代表(填“温度”或“压强”)判断的理由是 
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比 ![]() 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因:
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因:
【答案】
(1)﹣262.7kJ?mol﹣1;C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ?mol﹣1
(2)0.075mol?L﹣1?min﹣1
(3)>;1.2mol?L﹣1
(4)温度;图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件
(5)当投料比小于1时,随着c(H2)增大,反应①的平衡正向移动,CO转化率增大,因此二甲醚和甲醇的产率增大;当投料比大于1时,随着c(H2)增大,反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小
【解析】解:(1)①CO(g)+2H2(g)CH3OH(g)△H1=﹣99kJmol﹣1②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=﹣23.5kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=﹣41.2kJmol﹣1
依据盖斯定律计算①×2+②+3得到催化反应室中的总反应的热化学方程式:3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)△H=﹣262.7kJmol﹣1 ,
产业链中某反应的平衡常数表达式为K= ![]() ,反应的化学方程式为:H2O(g)+C(s)H2(g)+CO(g),每生成1mol H2需要吸收131.3kJ的热量,生成2g氢气放热131.3KJ,结合热化学方程式书写方法写出,C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJmol﹣1 ,
,反应的化学方程式为:H2O(g)+C(s)H2(g)+CO(g),每生成1mol H2需要吸收131.3kJ的热量,生成2g氢气放热131.3KJ,结合热化学方程式书写方法写出,C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJmol﹣1 ,
所以答案是:﹣262.7kJmol﹣1 , C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJmol﹣1;(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6molL﹣1 , c(H2)=1.4molL﹣1 , 8min后达到平衡,CO的转化率为50%,
CO(g)+ | 2H2(g) | CH3OH(g) | ||
起始量(mol/L) | 0.6 | 1.4 | 0 | |
变化量(mol/L) | 0.3 | 0.6 | 0.3 | |
8min量(mol/L) | 0.3 | 0.8 | 0.3 |
反应速率v= ![]() =
= ![]() =0.075 molL﹣1min﹣1 ,
=0.075 molL﹣1min﹣1 ,
则8min内H2的平均反应速率为0.075 molL﹣1min﹣1 ,
所以答案是:0.075 molL﹣1min﹣1;(3)①2CH3OH(g)CH3OCH3(g)+H2O(g),浓度商= ![]() =4.7<400,平衡正向移动,则v正 大于 v逆 ,
=4.7<400,平衡正向移动,则v正 大于 v逆 ,
所以答案是:大于;
②设达到平衡时二甲醚反应的物质的量浓度为xmol/L,
该反应
2CH3OH(g) | CH3OCH3(g)+ | H2O | ||
开始(mol/L) | 0.46 | 1 | 1 | |
反应(mol/L) | 2x | x | x | |
平衡(mol/L) | 0.46﹣2x | 1+x | 1+x |
化学平衡常数K= ![]() =400
=400
x=0.2,
则平衡时二甲醚的物质的量浓度=(1+0.2)mol/L=1.2mol/L,
所以答案是:>; 1.2 molL﹣1;(4)3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)△H=﹣262.7kJmol﹣1 , 反应为气体体积减小的放热反应,温度升高平衡逆向进行,一氧化碳转化率减小,增大压强平衡正向进行,一氧化碳转化率增大,图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件,
所以答案是:温度;图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件;(5)图象中曲线变化特征分析,二甲醚产率和甲醇产率变化的原因:当投料比小于1时,随着c(H2)增大,反应①的平衡正向移动,CO转化率增大,因此二甲醚和甲醇的产率增大;当投料比大于1时,随着c(H2)增大,反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小,
所以答案是:当投料比小于1时,随着c(H2)增大,反应①的平衡正向移动,CO转化率增大,因此二甲醚和甲醇的产率增大;当投料比大于1时,随着c(H2)增大反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小;
【考点精析】本题主要考查了反应速率的定量表示方法和化学平衡状态本质及特征的相关知识点,需要掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t;化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】如下图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化.下列说法正确的是( ) 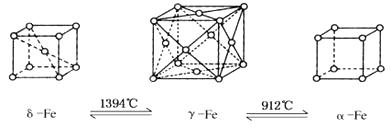
A.γFe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.αFe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.将铁加热到1 500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D.三种同素异形体的性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室某浓硫酸的试剂瓶上的标签如右图所示,根据标签上的有关数据回答下列问题: 
(1)该试剂中 H2SO4的物质的量浓度为molL﹣1 .
(2)某同学欲配制920mL物质的量浓度为0.30molL﹣1的稀硫酸,首先选择量程为mL的容量瓶,然后经理论计算需要量取mL上述浓硫酸(计算结果保留小数点后一位).
(3)下列各项实验操作或判断正确的是(填写字母).
A.配制0.1mol/L CuSO4溶液100mL,需称量CuSO45H2O 1.6g
B.在天平左右两盘中各放一张白纸后,可将NaOH固体放在右盘白纸上称量
C.用量筒可以精确量取25.03mL某种液体
D.需要235mL 0.9mol/L NaCl溶液,一般用250mL容量瓶进行配制
E.将配制好一定物质的量浓度的溶液,注入刚用水洗净的试剂瓶中,浓度不受影响.
(4)下列情况将使配制溶液的物质的量浓度偏低的有(填序号).
A.容量瓶用蒸馏水洗净后,未等内壁干燥便用来配制
B.烧碱在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中
C.定容时,仰视刻度线
D.摇匀静置后,发现液面未到刻度线,继续补加水至刻度线
E.在溶解过程中有少量液体溅出烧杯外.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用物理方法从植物体中提取,或是用化学方法合成药用化学物质,治疗病症,挽救性命,一直是科学家们致力研究的课题.请用化学知识分析“青蒿素”、“华法林”两种药物的结构及合成过程.
(1)2015年诺贝尔医学奖授予中国女药学家屠呦呦.“因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.” 
下列关于青蒿素和双氢青蒿素(结构如图1所示)的说法错误的是 .
A.青蒿素分子中含有过氧键、酯基和醚键
B.青蒿素的分子式为C15H22O5
C.由双氢青蒿素转化为青蒿素的反应属氧化反应
D.双氢青蒿素分子中有2个六元环和2个七元环
(2)华法林是一种治疗心脑血管疾病的药物,其合成路径如图2(部分反应条件略去). 
已知:①![]()
②
(I)A属于芳香烃,名称是;
(II)C生成D的反应类型是; E与N合成华法林的反应类型是 .
(III)B→C的转化过程中的化学反应方程式为;
(IV)E的结构简式是 . L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为 .
(V)K有多种同分异构体,满足下列条件的K的同分异构体还有种.
①属于芳香族化合物 ②遇到FeCl3显紫色 ③可发生水解反应.
写出其中满足核磁共振氢谱图显示峰值比为1:2:2:2:1的同分异构体的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是
A. 氢氧化钙可用来治疗胃酸过多B. 活性炭可用作水处理时的杀菌剂
C. 铝制容器可用来储运浓硝酸D. 氧化钠可用作潜水艇里氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法中不正确的是( )
A. 活化分子之间的碰撞不一定都是有效碰撞
B. 升高温度,可使单位体积内活化分子增多,反应速率加快
C. 对于有气体参加的反应增大压强,可使单位体积内活化分子百分数增加,反应速率加快
D. 催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所谓手性分子是指在分子中,当一个碳原子上连有彼此互不相同的四个原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子.凡是有一个手性碳原子的物质一定具有光学活性.例如,有机化合物( ![]() )有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
)有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
A.与乙酸发生酯化反应
B.与NaOH水溶液共热
C.与银氨溶液作用
D.在催化剂存在下与氢气作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com