
����Ŀ����ν���Է�����ָ�ڷ����У���һ��̼ԭ�������б˴˻�����ͬ���ĸ�ԭ�ӻ�ԭ����ʱ���ƴ˷���Ϊ���Է��ӣ�����̼ԭ��Ϊ����̼ԭ�ӣ�������һ������̼ԭ�ӵ�����һ�����й�ѧ���ԣ����磬�л������ ![]() ���й�ѧ���ԣ�����л�������ֱ������·�Ӧ�����ɵ��л������й�ѧ���Ե��ǣ� ��
���й�ѧ���ԣ�����л�������ֱ������·�Ӧ�����ɵ��л������й�ѧ���Ե��ǣ� ��
A.�����ᷢ��������Ӧ
B.��NaOHˮ��Һ����
C.��������Һ����
D.�ڴ�������������������
���𰸡�C
���������⣺A�� 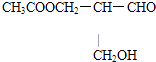 �����ᷢ��������Ӧ����Ӧ�����ɵ�������Cԭ��������������ͬ��CH3COOCH2��ԭ���ţ������й�ѧ���ԣ���A���� B��
�����ᷢ��������Ӧ����Ӧ�����ɵ�������Cԭ��������������ͬ��CH3COOCH2��ԭ���ţ������й�ѧ���ԣ���A���� B�� 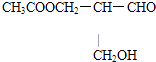 ��NaOH��Һ���ȷ���ˮ�⣬��Ӧ�����ɵ�������Cԭ��������������ͬ�ĩ�CH2OHԭ���ţ������й�ѧ���ԣ���B����
��NaOH��Һ���ȷ���ˮ�⣬��Ӧ�����ɵ�������Cԭ��������������ͬ�ĩ�CH2OHԭ���ţ������й�ѧ���ԣ���B����
C�� 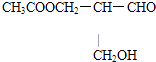 ��������Һ���ñ���������CHO���ɩ�COOH��Cԭ��������4����ͬ��ԭ�ӻ�ԭ���ţ����й�ѧ���ԣ���C��ȷ��
��������Һ���ñ���������CHO���ɩ�COOH��Cԭ��������4����ͬ��ԭ�ӻ�ԭ���ţ����й�ѧ���ԣ���C��ȷ��
D�� 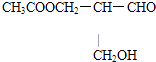 �ڴ�����������H2���ã���CHO���ɩ�CH2OH����Ӧ�����ɵ�������Cԭ��������������ͬ�ĩ�CH2OHԭ���ţ������й�ѧ���ԣ���D����
�ڴ�����������H2���ã���CHO���ɩ�CH2OH����Ӧ�����ɵ�������Cԭ��������������ͬ�ĩ�CH2OHԭ���ţ������й�ѧ���ԣ���D����
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Դ�ǵ����о����ȵ����⣮�����ѣ�CH3OCH3����δ������������ͺ�Һ������Ϊ�ྻҺ��ȼ��ʹ�ã���ҵ����CO��H2Ϊԭ������CH3OCH3 �� ��ҵ�Ʊ��������ڴ���Ӧ���У�ѹ��2.0��10.0Mpa���¶�230��280�棩�������з�Ӧ��
��CO��g��+2H2��g��CH3OH��g����H1=��99kJmol��1
��2CH3OH��g��CH3OCH3��g��+H2O��g����H2=��23.5kJmol��1
��CO��g��+H2O��g��CO2��g��+H2��g����H3=��41.2kJmol��1
��1������Ӧ���е��ܷ�Ӧ3CO��g��+3H2��g��CH3OCH3��g��+CO2��g���������H= �� ��Ӧԭ������ú����������֪�÷�Ӧ��ƽ�ⳣ������ʽΪK= ![]() ��ÿ����1mol H2��Ҫ����131.3kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��ÿ����1mol H2��Ҫ����131.3kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��2���ڸ������£�����Ӧ�ٵ���ʼŨ�ȷֱ�Ϊ��c��CO��=0.6molL��1 �� c��H2��=1.4molL��1 �� 8min��ﵽƽ�⣬CO��ת����Ϊ50%����8min��H2��ƽ����Ӧ����Ϊ ��
��3����t��ʱ����Ӧ�ڵ�ƽ�ⳣ��Ϊ400�����¶��£���1L���ܱ������м���һ���ļ״�����Ӧ��ijʱ�̲�ø���ֵ����ʵ���Ũ�����£�
���� | CH3OH | CH3OCH3 | H2O |
c��molL��1�� | 0.46 | 1.0 | 1.0 |
��ʱ��v��v�����������������=������ƽ��ʱc��CH3OCH3�������ʵ���Ũ���� ��
��4���ڣ�1��С���д���Ӧ�ҵ��ܷ�Ӧ3CO��g��+3H2��g��CH3OCH3��g��+CO2��g����CO��ƽ��ת����a��CO�����¶ȡ�ѹǿ�Ĺ�ϵ��ͼ1��ʾ��ͼ��X��������¶ȡ���ѹǿ�����жϵ������� 
��5���ڴ�����������ͬʱ����������Ӧ������������ʼͶ�ϱ� ![]() �ĸı䣬�����Ѻͼ״��IJ��ʣ������е�̼ԭ��ռ��ʼCO��̼ԭ�ӵİٷ��ʣ�������ͼ2�ı仯���ƣ��Խ��Ͷ����Ѳ��ʺͼ״����ʱ仯��ԭ��
�ĸı䣬�����Ѻͼ״��IJ��ʣ������е�̼ԭ��ռ��ʼCO��̼ԭ�ӵİٷ��ʣ�������ͼ2�ı仯���ƣ��Խ��Ͷ����Ѳ��ʺͼ״����ʱ仯��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪̼�����ֳ�����ͬλ��12C��13C����Ҳ�г���������ͬλ��16O��17O��18O������5�����ӹ��ɵĶ�����̼�����У�����Է���������������
A. 6��B. 10��C. 11��D. 12��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������
��1����ҵ����ȡ�������Ҫ����ͼ��ͼ1�� 
��I����ҵ�ϳɰ���ԭ����N2��H2 �� װ��A��������������N2�ɴӿ����з���������������Ƚ����� �� Ȼ�����ɵõ���H2����ˮ����Ȼ��Ϊԭ���ڴ��������¸�����ȡ���仯ѧ����ʽΪ ��
��II����ԭ�����Ʊ������л��е�CO�Դ����ж������ã�����ȥԭ�����е�CO����ͨ�����·�Ӧ��CO��g��+H2O��g���TCO2��g��+H2��g����ʵ�֣���֪1100Kʱ�÷�Ӧ��ƽ�ⳣ��K=0.64����ҪʹCO��ת���ʳ���80%������ʼ����c��H2O����c��CO�������� ��
��2������ʯ��������ȥ���Ṥҵ��β������NO��NO2�������ܾ���β�������ܻ��Ӧ�ù㷺��Ca��NO2��2 �� �䲿�ֹ���������ͼ2����֪NO��NO2��1��1ͨ���Һ�������������Σ� 
��I�����������в�������Һ�����Ӵ����գ�β�������������룬ʯ����������������ܣ�����Ŀ������������ѭ��ʹ�ã���������Ҫ�ɷ������ѧʽ����
��II���ù��������NO ��NO2 ���ʵ���֮�Ƚӽ�1��1����n��NO����n��NO2����1��1����ᵼ������n��NO����n��NO2����1��1����ᵼ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A. ˮ������Ư�ۡ�������Ϊ�����
B. ����������һ���ǽ�����������������ﲻһ���Ǽ���������
C. �ܵ����H+������������
D. ����������һ������������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ������װ����ͼ�� 
��1��ʵ������ȡ�����Ļ�ѧ����ʽΪ��MnO2+4HCl��Ũ��=MnCl2++2H2O��������
��2��ʵ����ͨ���ñ���ʳ��ˮ�������� �� Bƿʢװ���Լ���
��3��Cװ������������ �� ��Ӧ�Ļ�ѧ����ʽΪ
��4�����������Ƿ�й©��ʪ����ֽ����й©��ֽ��ɫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʻ�Ϊͬ���칹���һ����
A. ˮ��������B. 12C��14CC. ��������춡��D. O2��O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѧA��Y��Liu�����״κϳ�����ʯ�൪��̼���©���C3N4�������ݴ�ѧ���³������ڴ˻������Ե��谷��CH2N2��Ϊԭ���Ƶù������ʯī�൪��̼��g��C3N4�����䵥��ṹ��ͼa�� 
��1��C��H��NԪ�ص縺�ԴӴ�С��˳��Ϊ����Ԫ�ط��ţ���
��2���©���C3N4�۵㡢Ӳ�Ⱦ����ڽ��ʯ����ԭ��Ϊ ��
��3���©���C3N4��g����C3N4��̼ԭ�ӵ��ӻ�������ͷֱ�Ϊ ��
��4�����谷�ĽṹʽΪ ��
��5��g����C3N4�д��ڵ�������Ϊ������ţ���
a�����Ӽ� b���Ҽ� c���м� d����� e�����»���
��6��g����C3N4�в���������Ԫ������߹��Ч����ͼbΪg����C3N4����һ�ֵ���ṹ��ͼcΪFe3+����ǰ��N��1s��ͼ��Nԭ��1s��XPS��ͼ��ͼ�з��ǿ��������ԭ����Ŀ����ͼc�к�����Ϊg����C3N4��N��1s����ܣ�ԭ�ӽ�������ȶ��Գ����ȣ�������Fe3+�������С�����߷������������ƣ�
��Fe3+�ļ۵��ӹ����ʾʽΪ ��
�ڷ���λ�Ƶ����߶�Ӧ��Nԭ��Ϊ����ͼb�е���ţ���
���������Ƶ�ԭ��Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ������������ȷ����(����)
A. ���ݶ����ЧӦ�ɽ���ɢϵ��Ϊ��Һ����������Һ
B. ��Һ�ǵ����Եģ������Ǵ����
C. �������ܽ������ж����ЧӦ
D. ��Һ���������ӵ��˶��й��ɣ������з�ɢ�����ӵ��˶����ɣ��������˶�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com