
科目: 来源: 题型:
【题目】浓硫酸具有很强的吸水性,下列实验不能说明该观点的是
A. 浓硫酸滴到白纸上,白纸变黑
B. 浓硫酸暴露在潮湿的空气中,浓度变稀
C. 在浓硫酸中加入少量胆矾,胆矾变白色
D. 含水蒸汽的氢气通过浓硫酸后,氢气变干燥
查看答案和解析>>
科目: 来源: 题型:
【题目】CuSO4溶液与K2C2O4溶液混合反应,产物之一是某种只含一种阴离子的蓝色钾盐水合物.通过下述实验确定该晶体的组成.
步骤a:称取0.6720g样品,放入锥形瓶,加入适量2molL﹣1稀硫酸,微热使样品溶解.再加入30mL水加热,用0.2000molL﹣1 KMnO4溶液滴定至终点,消耗8.00mLKMnO4溶液.
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色.冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI.用0.2500molL﹣1 Na2S2O3标准溶液滴定至终点,消耗8.00mLNa2S2O3溶液.
已知涉及的部分反应的离子方程式为:
步骤a:2MnO4﹣+5C2O42﹣+16H+=2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I﹣=2CuI↓+I2 I2+2S2O32﹣=2I﹣+S4O62﹣
(1)已知室温下CuI的Ksp=1.27×10﹣12 , 欲使溶液中c(Cu+)≤1.0×10﹣6molL﹣1 , 应保持溶液中c(I﹣)≥molL﹣1 .
(2)MnO4﹣在酸性条件下,加热能分解为O2 , 同时生成Mn2+ .
写出该反应的离子方程式为 .
若无此加热操作,则测定的Cu2+的含量将会(填“偏高”、“偏低”或“不变”).
(3)步骤b用淀粉溶液做指示剂,则滴定终点观察到的现象为 .
(4)通过计算确定样品晶体的组成.
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组根据老师的学案设计实验对碳酸钠和碳酸氢钠的性质进行研究.
(1)甲同学设计除去碳酸氢钠溶液中碳酸钠杂质的方法:向溶液中通入足量的二氧化碳.请写出相关反应的离子方程式 .
(2)乙同学设计如图实验装置,比较碳酸氢钠和碳酸钠的热稳定性,并检验分解产物.最好应在a试管底部加入(填化学式). 
(3)小苏打长期放置在空气中会变质(部分转变为碳酸钠),丙同学称取27.4g变质小苏打样品,经过充分加热、冷却、称量,所得固体的质量为21.2g,则原混合物中碳酸钠的质量为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
A. 液溴和乙醇分别受热变为气体
B. 干冰和氯化铵分别受热变为气体
C. 硅和白磷分别受热熔化
D. 氯化氢和蔗糖分别溶解于水
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( ) 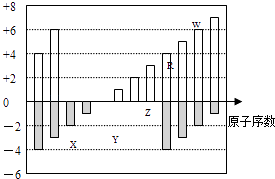
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外小组用如图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)。
(1)写出A中反应的化学方程式。
(2)观察到A中的现象是。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 , 写出有关的化学方程式:。
(4)C中盛放CCl4的作用是。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入 , 现象是。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中A是制取溴苯的实验装置,B、C是改进后的装置,请仔细分析,对比三个装置,回答以下问题: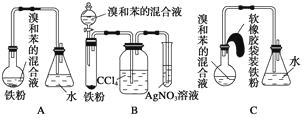
(1)写出三个装置中所共同发生的两个反应的化学方程式:;。
写出B中盛有AgNO3溶液的试管中所发生反应的化学方程式:。
(2)装置A和C均采用了长玻璃导管,其作用是。
(3)在按装置B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是;
应对装置C进行的操作是。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是。
(5)B中采用了洗气瓶吸收装置,其作用是 , 反应后洗气瓶中可能出现的现象是。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某饱和氯化钠溶液的体积为V mL,密度为ρ gmL﹣1 , 质量分数为w,物质的量浓度为c molL﹣1 , 溶液中所含NaCl的质量为m g.下列选项正确的是( )
A.该温度下NaCl的溶解度S= ![]() ?g
?g
B.溶液中溶质的物质的量浓度c(NaCl)= ![]() ?mol?L﹣1
?mol?L﹣1
C.溶液中溶质的物质的量浓度c(NaCl)= ![]() ?mol?L﹣1
?mol?L﹣1
D.溶液中溶质的质量分数w= ![]() %
%
查看答案和解析>>
科目: 来源: 题型:
【题目】将大部分已经锈蚀(成分为Fe2O3)的废铁屑制备绿矾(FeSO47H2O),实验操作过程如下: 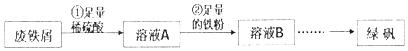
已知:杂质不溶于稀硫酸.
请回答下列问题:
(1)步骤①中,稀硫酸与Fe2O3反应的方程式为 , 废铁屑用硫酸处理后,还含有不溶性杂质,为获取澄清的A溶液,需进行的操作名称是 .
(2)步骤②中溶液A与铁粉反应的离子方程式为 .
(3)检验溶液B中是否还存在Fe3+的方法是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置图如右图所示。回答下列问题:
(1)反应需在50~60℃的温度下进行,图中给反应物加热方法是 , 它的优点是和。
(2)在配制混合酸时应将加入中。
(3)该反应的化学方程式是。
(4)反应完毕后,除去混合酸,所得粗产品用如下操作精制:①蒸馏 ②水洗 ③用干燥剂干燥 ④10%NaOH溶液洗 ⑤水洗,其中正确的操作顺序是______。
A.①②③④⑤
B.②④⑤③①
C.④②③①⑤
D.②④①⑤③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com