
科目: 来源: 题型:
【题目】在一定条件下,某化合物X受热分解:2X=A↑+2B↑+4C↑。测得反应后生成的混合气体对H2的相对密度为d,在相同条件下,X的相对分子质量是
A. 2d B. 7d C. 5d D. 3.5d
查看答案和解析>>
科目: 来源: 题型:
【题目】铬铁矿的主要成分可以表示为FeOCr2O3 , 还含有SiO2、Al2O3杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)过程如图所示. 
已知:CrO42﹣和Cr2O72﹣在酸性条件下可以相互转化.
请回答下列问题:
(1)完成并配平下列方程式: 6FeO+6Cr2O3+KOH+KClO3=K2CrO4+Fe2O3+KCl+
(2)滤渣1的成分是(填化学式),滤液1的成分除K2CrO4、KClO3、KOH外,还含有(填化学式),过滤后洗涤沉淀的操作是 .
(3)试剂1是(填化学式),利用滤渣2可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,电解时阴极的电极反应式为 .
(4)对滤液2用稀硫酸酸化处理时发生的离子反应方程式是 , 酸化处理时往往增大稀硫酸浓度的原因是 .
(5)检验氯酸钾晶体中钾元素的具体方法是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】CO和H2混合气体3 g和足量的氧气燃烧后,在150℃时将混合气体通过足量的Na2O2后,Na2O2增重的质量为
A.1.5 g B.3 g C.6 g D.无法计算
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热方程式书写正确的是( )
A.2SO2+O2=2SO3△H=﹣196.6 kJ/mol
B.2H2(g)+O2(g)=2H2O(l)△H=﹣517.6 kJ/mol
C.H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8 kJ
O2(g)=H2O(l)△H=﹣285.8 kJ
D.C(s)+O2(g)=CO2(g)△H=+393.5 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A. 含有不同种元素的纯净物叫做化合物 B. 盐中一定含有金属元素
C. 水溶液中能电离出H+的化合物一定是酸 D. 含有氧元素的化合物一定是氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】有机化合物J是在医疗上有重要的应用,分子结构中含有3个六元环.其中一种合成路线如图: 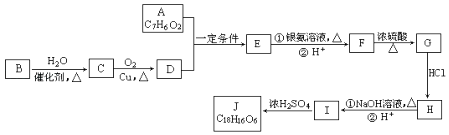
已知:
①A既能发生银镜反应,又能与FeCl3溶液发生显色反应,其核磁共振氢谱显示有4个吸收峰,且峰面积之比为1:2:2:1.
②有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平.
③R1﹣CHO+R2﹣CH2﹣CHO ![]()
![]()
请回答下列问题:
(1)E的结构简式是 , G中含氧官能团的名称 .
(2)写出有机反应类型H→I , F→G .
(3)写出I生成J的化学方程式 .
(4)A的含苯环同分异构体有种,写出其中符合以下要求的同分异构体的结构简式 . ①能发生银镜反应 ②能发生水解反应 ③含有苯环
(5)写出用B合成 ![]() 的路线图(提示:路线图的书写方法RCH=CH2
的路线图(提示:路线图的书写方法RCH=CH2![]()
![]()
![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】锂﹣磷酸氧铜电池正极的活性物质是Cu4O(PO4)2 , 可通过下列反应制备: 2Na3PO4+4CuSO4+2NH3H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
请回答下列问题:
(1)写出基态Cu2+的外围电子排布式: . C、N、O三种元素的第一电离能由小到大的顺序为(用元素符号表示).
(2)PO43﹣的空间构型是 .
(3)比较CuSO4晶体与干冰熔点相对高低,并解释原因 .
(4)氨基乙酸铜的分子结构如图,其中碳原子的杂化方式为 .
(5)在硫酸铜溶液中加入过量氨水,生成配合物离子四氨合铜,请写出四氨合铜离子的结构式 .
(6)铁和铜是重要的金属,Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.六氰合亚铁离子[Fe(CN)6]4﹣中不存在 .
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
(7)NaCl晶胞中若r(Na+)=a pm,r(Cl﹣)=b pm,则NaCl晶胞的空间利用率为 . (晶胞中离子以密堆积方式存在,用含有a,b的列式表示) 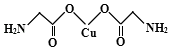
查看答案和解析>>
科目: 来源: 题型:
【题目】以下物质之间的每步转化中,都能通过一步实现的是( )
①Fe→FeCl2→Fe(OH)2→ Fe(OH)3
②Na→Na2O→Na2CO3→NaHCO3→NaOH
③Mg→MgCl2→Mg(OH)2
④Al→Al2O3→Al(OH)3
⑤Al→NaAlO2→Na2CO3
A. ②③④ B. ①③④⑤ C. ①②③⑤ D. ①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃和101kPa时
①CO(g)+ ![]() O2(g)═CO2(g)△H1=﹣a kJ/mol
O2(g)═CO2(g)△H1=﹣a kJ/mol
②H2(g)+ ![]() O2(g)═H2O(l)△H2=﹣b kJ/mol
O2(g)═H2O(l)△H2=﹣b kJ/mol
③C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H3=﹣c kJ/mol
(1)试计算2CO(g)+4H2(g)═H2O(l)+C2H5OH(l)的△H= .
(2)对反应N2O4(g)2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法 不正确的是________
A.A、C两点的反应速率:A<C
B.B、C两点的气体的平均相对分子质量:B>C
C.A、C两点气体的颜色:A深,C浅
D.由状态A到状态B,可以用降温的方法
(3)在100℃时,将0.50mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.50 | n1 | 0.34 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.10 | 0.10 |
①上述条件下,前20秒二氧化氮的平均反应速率为 ,平衡时二氧化氮的转化率为 .
②该温度下,反应的平衡常数K值为 .(保留一位小数)
(4)甲醇﹣空气的燃料电池(电解质为KOH溶液)得到广泛应用,请写出该燃料电池负极的电极反应式 ,若通入空气之前电解质KOH溶液的浓度为0.6mol/L,体积为100mL,当电子转移0.15mol后电解质溶液的pH为 .(体积保持不变,室温条件)
(5)电离度指弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数的百分数.若室温下,c mol/L氨水的电离平衡常数为Kb , 则该氨水的电离度 α= .(请用c和Kb表示,可进行近似计算)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com