
科目: 来源: 题型:
【题目】煤的气化主要反应是煤中碳与水蒸气反应生成CO、H2等,回答下列问题:
(1)CO和H2分别与O2都可以设计成燃料电池,CO与O2设计成燃料电池(以熔融碳酸盐为电解质)负极的电极反应为
(2)在煤的气化获得的化工原料气中含有少量羰基硫(COS),能引起催化中毒、大气污染等,COS的电子式为羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为羰基硫的脱硫常用两种方法,其反应式分别为: ①氢解反应:COS(g)+H2(g)═H2S(g)+CO(g)△H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)═H2S(g)+CO2(g)△H2
已知反应中相关的化学键键能数据如表
化学键 | C=O(CO2) | C=O(COS) | C=S | H﹣S | H﹣O |
键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
则△H2=kJ/mol
(3)脱硫处理后的CO和H2在催化剂作用下合成甲醇:CO2(g)+3H 2(g)CH3OH(g)+H2O(g)△H2=﹣90.14kJ/mol,该反应能自发的理由是 . ①一定温度下,在两个容积都为VL的恒容密闭容器中,找如下方式反应物,一段时间后达到平衡
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | mmolCO2、3mmolH2、 |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则n的取值范围为 , 反应的平衡常数K= .
②甲容器保持恒容,欲增大H2的平衡转化率,可采取的措施有(答两点即可).
查看答案和解析>>
科目: 来源: 题型:
【题目】草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾等。现从某草木灰样品中提取钾盐,并检验其中的![]() 、
、![]() 和Cl。
和Cl。
(1)从草木灰中提取钾盐的实验操作步骤如下,请补充完整:
① ②过滤 ③蒸发浓缩 ④冷却结晶 ⑤过滤。
(2)上述操作中需要用到玻璃棒的是 (填序号)。
(3)将制得的少量晶体加水溶解后,分别置于三支试管中。
①向第一支试管中加入少量稀盐酸,可观察到 ,说明溶液中存在 离子。
②向第二支试管中加入 ,可观察到 ,说明溶液中存在![]() 。
。
③向第三支试管中先加入足量Ba(NO3)2溶液,过滤后,再向滤液中加入足量 溶液,可观察到白色沉淀,说明溶液中存在Cl。其中,加入足量Ba(NO3)2溶液的目的是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。(已知:NH4HCO3![]() NH3↑+CO2↑+H2O)
NH3↑+CO2↑+H2O)

如果此方案正确,那么:
(1)进行操作①可选择的最常用仪器是______________。
(2)操作②为什么不用硝酸钡溶液,其理由是_____________________________。
(3)进行操作②后,如何判断![]() 已除尽,方法是_________________________。
已除尽,方法是_________________________。
(4)操作③的目的是________________,为什么不先过滤后加碳酸钠溶液?理由是____________。
(5)操作④的目的是________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:
H2(g)+ ![]() O2(g)═H2O(l)△H=﹣285.8kJ/mol;
O2(g)═H2O(l)△H=﹣285.8kJ/mol;
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣2220.0kJ/mol;
H2O(l)═H2O(g)△H=+44.0kJ/mol.
(1)写出丙烷燃烧生成CO2和气态水的热化学方程式:
(2)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kj,则混合气体中H2和C3H8的体积比为多少?
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:
H2(g)+ ![]() O2(g)═H2O(l)△H=﹣285.8kJ/mol;
O2(g)═H2O(l)△H=﹣285.8kJ/mol;
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣2220.0kJ/mol;
H2O(l)═H2O(g)△H=+44.0kJ/mol.
(1)写出丙烷燃烧生成CO2和气态水的热化学方程式:
(2)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kj,则混合气体中H2和C3H8的体积比为多少?
查看答案和解析>>
科目: 来源: 题型:
【题目】钴周期表第四周期第ⅥⅡ族元素,其化合价用途广泛,如:LiCoO2做锂电池的正极材料,草酸钴可用于指示剂和催化剂制备.
(1)Ⅰ LiCoO2中钴元素的化合价为 .
(2)工业上将废锂电池的正极材料与过氧化氢溶液、稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为可用盐酸代替H2SO4和H2O2的混合液,但缺点是 .
(3)Ⅱ 利用一种含钴矿石[主要成分为Co2O3 , 含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O42H2O工艺流程如下: 
已知:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
浸出过程中加入NaClO3的目的是 .
(4)请用平衡移动原理说明加Na2CO3调PH至5.2生成沉淀的原因 .
(5)滤液Ⅱ中加入萃取剂的作用是 .
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10﹣11 , Ksp(CaF2)=1.05×10﹣10 . 当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)= .
查看答案和解析>>
科目: 来源: 题型:
【题目】【改编题】不规范的实验操作都有安全隐患,进入高中后化学实验明显增多,作为高中生实验时要规范操作。请改正下列各操作中的错误(在下图对应的横线上用文字简要回答)。
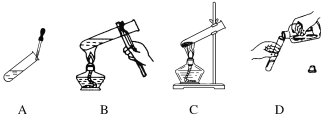
A.________________________________________________________________________
B.________________________________________________________________________
C.________________________________________________________________________
D.________________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L密闭容器中将4 mol气体A和2 mol气体B混合,在一定温度下发生反应:3A(g)+2B(g)xC(g)+2D(g).2min后达到平衡时生成1.6mol C,又测得反应速率v(D)=0.2mol/(Lmin),下列说法正确的是( )
A.x=4
B.B的转化率为60%
C.A的平衡浓度是2.8mol/L
D.平衡时气体的压强是原来的0.94倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com