
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。(已知:NH4HCO3![]() NH3↑+CO2↑+H2O)
NH3↑+CO2↑+H2O)

如果此方案正确,那么:
(1)进行操作①可选择的最常用仪器是______________。
(2)操作②为什么不用硝酸钡溶液,其理由是_____________________________。
(3)进行操作②后,如何判断![]() 已除尽,方法是_________________________。
已除尽,方法是_________________________。
(4)操作③的目的是________________,为什么不先过滤后加碳酸钠溶液?理由是____________。
(5)操作④的目的是________________________________________________。
【答案】(1)坩埚
(2)用Ba(NO3)2会使溶液中引入新的杂质离子![]() ,在后续操作中无法除去
,在后续操作中无法除去
(3)取上层清液加入BaCl2溶液,若无沉淀生成说明![]() 已除尽
已除尽
(4)除去过量的Ba2+ 先加Na2CO3后过滤,可以减少一次过滤操作
(5)除去溶解在溶液中的CO2和HCl
【解析】(1)操作①为加热使NH4HCO3受热分解,因此可选择的最常用仪器是坩埚。
(2)若用Ba(NO3)2会使溶液中引入新的杂质离子![]() ,在后续操作中无法除去。
,在后续操作中无法除去。
(3)判断![]() 已除尽的方法:取上层清液加入BaCl2溶液,若无沉淀说明
已除尽的方法:取上层清液加入BaCl2溶液,若无沉淀说明![]() 已除尽。
已除尽。
(4)操作③“加入Na2CO3溶液”,目的是除去过量的Ba2+。先加Na2CO3后过滤,可以减少一次过滤操作。
(5)除去溶解在溶液中的CO2和HCl。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】关于同主族元素从上到下的下列说法不正确的是( )
A. 原子半径依次增大B. 金属性逐渐增强
C. 非金属性逐渐减弱D. 原子得电子能力逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品:

(1)“酸浸”时加快反应速率的方法除了增加硫酸的浓度和加热外,还有___________________。(写出一种)
(2)在加NaOH调节溶液的pH时约为5,如果pH过大,可能导致滤渣1中 ___________________(填化学式)的含量减少。
(3)取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8(过二硫酸氨)溶液,加热,Mn2+被氧化为MnO4-,反应一段时间后再煮沸5 min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,平均消耗(NH4)2Fe(SO4)2标准溶液的体积为V mL。
①Mn2+与(NH4)2S2O8反应的离子方程式为___________________________________________。
②用含a、b、V的代数式表示“沉锰”前溶液中c(Mn2+)=_______________。
(4)①写出“沉锰”时的离子方程式:___________________________________________。
②在其他条件相同时,NH4HCO3的初始浓度越大,锰元素回收率越高,请从沉淀溶解平衡的角度解释其原因___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 对平衡体系H2(g)+I2(g)![]() 2HI(g)加压后,混合气体的颜色加深
2HI(g)加压后,混合气体的颜色加深
B. 用稀盐酸洗涤AgCl沉淀比用等体积的蒸馏水洗涤损失的AgCl少
C. 实验室可用排饱和食盐水的方法收集氯气
D. 工业合成三氧化硫的过程中使用过量的氧气,以提高二氧化硫的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥加聚反应 ⑦酯化反应
A. ②⑤⑥B. ②④⑤C. 只有⑥D. 只有⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾等。现从某草木灰样品中提取钾盐,并检验其中的![]() 、
、![]() 和Cl。
和Cl。
(1)从草木灰中提取钾盐的实验操作步骤如下,请补充完整:
① ②过滤 ③蒸发浓缩 ④冷却结晶 ⑤过滤。
(2)上述操作中需要用到玻璃棒的是 (填序号)。
(3)将制得的少量晶体加水溶解后,分别置于三支试管中。
①向第一支试管中加入少量稀盐酸,可观察到 ,说明溶液中存在 离子。
②向第二支试管中加入 ,可观察到 ,说明溶液中存在![]() 。
。
③向第三支试管中先加入足量Ba(NO3)2溶液,过滤后,再向滤液中加入足量 溶液,可观察到白色沉淀,说明溶液中存在Cl。其中,加入足量Ba(NO3)2溶液的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI===2KCl+I2。请回答下列问题:
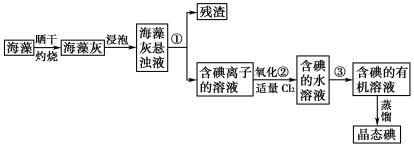
(1)指出提取碘的过程中有关实验操作①和③的名称:__________;________。
(2)在3 mL碘水中,加入1 mL四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________(注:试管中深色区为紫红色溶液)。

(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如下图实验装置中的错误之处。(加热装置中烧杯底部已垫有石棉网)

①________________________________;
②________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: B是相对分子质量为28的烃,核磁共振氢谱显示分子中只有一种化学环境的氢原子,A是烃的含氧衍生物。且有如下的转化关系:

(1)A的结构简式是___________________B的结构式是___________________
(2)反应①是D与HCl按物质的量之比1︰1的化合反应,则D的分子式是_________________,D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键.则D的结构简式是___________________。
(3)反应②可表示为:G + NH3 → F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示):_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是
混合物 | 试剂 | 分离方法 | |
A | CO2(SO2) | 饱和Na2CO3溶液 | 洗气 |
B | 乙烷(乙烯) | 氢气 | 加热 |
C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com