
科目: 来源: 题型:
【题目】工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
①2H2(g)+CO(g)CH3OH (g)△H=﹣90.8kJmol﹣1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H=﹣23.5kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41.3kJmol﹣1
(1)总合成反应的热化学方程式为 .
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是(填字母代号).
A.高温高压
B.加入催化剂
C.减少CO2的浓度
D.增加CO的浓度
E.分离出二甲醚
(3)已知反应②2CH3OH(g)CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如表格:
物质 | CH3OH | CH3OCH3 | H2O |
c/molL﹣1 | 0.44 | 0.60 | 0.60 |
此时,v(正)v(逆) 填“>”、“<”或“=”);达到平衡后,CH3OCH3的物质的量浓度是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
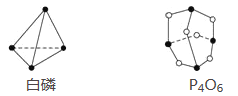
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
查看答案和解析>>
科目: 来源: 题型:
【题目】CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是( )

A. 该反应为吸热反应
B. 该反应不需要加热就能进行
C. 1 molCO(g)和1mol H2O(g)具有的总能量大于1 molCO2(g)和1 molH2(g)具有的总能量
D. 1 molCO2(g)和1 molH2(g)反应生成1 molCO(g)和1mol H2O(g)要放出41 kJ热量
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W为短周期元素,其原子半径、化合价等信息见下表。
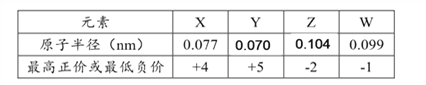
有关这四种元素的说法一定正确的是( )
A. X与W形成的化合物是离子化合物
B. Y的氢化物能与W的氢化物反应,所得产物只含有共价键
C. X、Y能分别与氧元素形成多种氧化物
D. Z处于元素周期表中第三周期ⅣA族
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 .
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃
查看答案和解析>>
科目: 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为 .
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 .
(4)已知:
N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
2H2(g)+O2(g)=2H2O(l)=﹣571.6kJmol﹣1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为: .
查看答案和解析>>
科目: 来源: 题型:
【题目】用NH3催化还原NxOy可以消除氮氧化物的污染.已知:反应I:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H1
反应II:2NO(g)+O2(g)2NO2(g)△H2 (且|△H1|=2|△H2|)
反应III:4NH3(g)+6NO2(g)5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)推测反应III是反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.①计算0~4分钟在A催化剂作用下,反应速率v(NO)= .
②下列说法正确的是 .
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H﹣O键与N﹣H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数﹣﹣φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2);恒温恒容容器,φ(NO2) .
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图2所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:①变为曲线Y改变的条件是 . 变为曲线Z改变的条件是 . 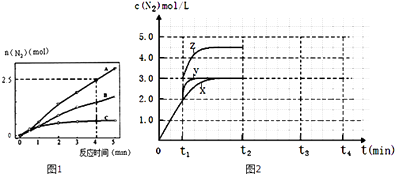
②若t2降低温度,t3达到平衡,请在上图中画出曲线X在t2﹣t4内 c(N2)的变化曲线 .
查看答案和解析>>
科目: 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I﹣(aq)I3﹣(aq),某I2、KI混合溶液中,c(I3﹣)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( ) 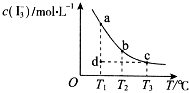
A.反应 I2(aq)+I﹣(aq)I3﹣(aq)△H>0
B.若温度为T1、T2 , 反应的平衡常数分别为K1、K2 , 则K2>K1
C.若T1时,反应进行到状态d时,一定有υ正>υ逆
D.状态a与状态b相比,状态b时I2的转化率更高
查看答案和解析>>
科目: 来源: 题型:
【题目】X,Y,Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
A.33%
B.40%
C.50%
D.65%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com