
科目: 来源: 题型:阅读理解
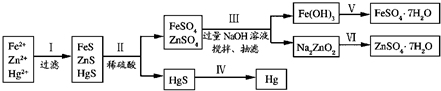
| 沉淀物 | Fe(OH)2 | Zn(OH)2 | Hg(OH)2 |
| 沉淀完全的pH | 9.7 | 8.0 | 5.3 |
| 沉淀物 | FeS | ZnS | HgS |
| 沉淀完全的pH | ≥4.92 | ≥2.72 | ≥2.5 |
| KSP | 3.7×10-19 | 1.2×10-23 | 4×10-53 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
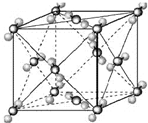 (2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
(2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.查看答案和解析>>
科目: 来源: 题型:

| 500aρ |
| 49a+b |
| 500aρ |
| 49a+b |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 1 |
| 50 |
| 1 |
| 50 |
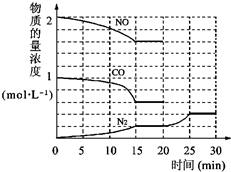 中NO(g)、CO(g)、N2(g)的物质的量浓度变化如图所示,则反应进行到15min时,NO的平均反应速率为
中NO(g)、CO(g)、N2(g)的物质的量浓度变化如图所示,则反应进行到15min时,NO的平均反应速率为查看答案和解析>>
科目: 来源: 题型:

| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
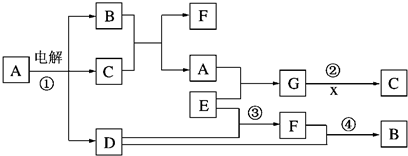
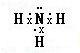
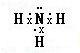
| ||
| ||
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:阅读理解
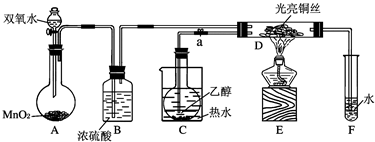
| Cu |
| △ |
| Cu |
| △ |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com