
科目: 来源: 题型:
【题目】实验室制Cl2反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O,下列说法不正确的是
MnCl2+Cl2↑+2H2O,下列说法不正确的是
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1mol Cl2,转移电子的物质的量为2mol
C. 每消耗1mol MnO2,起还原剂作用的HCl消耗4mol
D. 转移电子的物质的量为1mol时,生成标准状况下Cl2的体积为11.2L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式正确的是
A. 用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3===Ca2++2CH3COO-+CO2↑+H2O
B. NaOH溶液中通入Cl2 :2Cl2 + 2OH- = 3Cl- + ClO- + H2O
C. 稀硫酸中加入铁粉 2Fe+6H+===2Fe3++3H2↑
D. Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO+2OH-===CaCO3↓+CO![]() +2H2O
+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性. 物质 ![]() 有光学活性,发生下列反应:
有光学活性,发生下列反应:
①与乙酸发生酯化反应 ②与NaOH水溶液反应 ③在Cu作催化剂时与O2反应 ④与银氨溶液反应.发生哪些反应后生成的有机物无光学活性(填写符合题意的字母编号)
A.只有①②
B.只有②③
C.①②③
D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 向燃煤中加入石灰石可减少SO2的排放:2CaCO3 + O2 + 2SO2 ![]() 2CaSO4 + 2CO2
2CaSO4 + 2CO2
B. 足量铁粉与稀硝酸反应:Fe+4H++NO3- = Fe3++2H2O+NO↑
C. 用氨水除去烟气中的SO2:SO2+2NH3H2O=(NH4)2SO3+H2O
D. 用熟石灰处理泄漏的液氯:2Ca(OH)2 +2Cl2 = CaCl2 + Ca(ClO)2 +2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用下列方法测定某水样中O2的含量。

(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,再用I-将生成的MnO(OH)2再还原为Mn2+,第二步反应的离子方程式为___________________。然后用Na2S2O3标准溶液滴定生成的I2。
已知:①2Mn2++O2+4OH-=2 MnO(OH)2 ②I2+2Na2S2O3=2NaI+Na2S4O6。
③S2O32-+2H+=SO2↑+S+H2O
(2)实验步骤
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是______________;
②用注射器抽取某水样20.00 mL从A 处注入锥形瓶;
③再分别从A 处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液使溶液接近中性;
⑥重复④的操作。
⑦取下锥形瓶,向其中加入2~3滴________________作指示剂;
⑧用0.005 mol`L-1Na2S2O3滴定至终点。
(3)数据分析
①若在滴定过程中消耗的Na2S2O3标准溶液体积为3.60 mL,则此水样中氧气(O2)的含量为___(单位:mg·L-1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将____________(填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在常温常压下: ①2CH3OH(l)+2O2(g)═2CO(g)+4H2O(g)△H=﹣a kJmol﹣1
②2CO(g)+O2(g)═2CO2(g)△H=﹣b kJmol﹣1
③H2O(g)═H2O(l)△H=﹣c kJmol﹣1
则表示CH3OH(l)燃烧热的热化学方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】(16分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中的主要离子方程式为 。
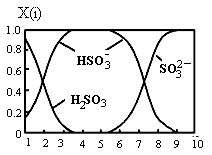 (2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
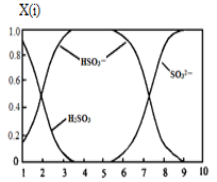
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下反应的离子方程 式 , 。
(4)装置Ⅲ还可以使Ce4+再生,其原理如图所示。①生成Ce4+从电解槽的 (填字母序号)口流出。②写出阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)

查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 硫酸与氢氧化钡溶液反应:H++ OH-= H2O
B. 稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++ 3H2↑
C. 氯气通入水中:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
D. AlCl3溶液中加入足量的氨水:Al3++ 3NH3·H2O = Al(OH)3↓+3NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读下列信息: Ⅰ.表中①~⑥为短周期元素主要化合价及最简单氢化物沸点的数据:
元素性质 | 元素编号 | |||||
① | ② | ③ | ④ | ⑤ | ⑥ | |
氢化物沸点(℃) | ﹣33.4 | 100 | 19.54 | ﹣87.7 | ﹣60.7 | ﹣84.9 |
主要化合价 | +5 | ﹣2 | ﹣1 | +5 | +6 | +7 |
A、B、C均为上表中的元素;
Ⅱ.A与B可形成化合物AB、AB2 , 二者可用于制备强酸甲;
Ⅲ.C与B可形成化合物CB2、CB3 , 二者可用于制备强酸乙.
请回答:
(1)该表中两种元素的氢化物所含电子数不同,这两种氢化物之间能发生反应,写出符合要求的化学方程式(有多组符合,写出任意一个即可).
(2)元素②氢化物的沸点高于元素⑤氢化物的沸点,原因是 .
(3)甲、乙分别与氨反应生成丙、丁、戊三种盐.0.1mol/L的甲、乙、丙、丁、戊五种溶液,pH由小到大排列的顺序是(填写化学式) .
(4)很稀的甲溶液与Zn反应,当反应的甲与Zn的物质的量之比为5:2时,还原产物可能为(填写化学式)、 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com