
【题目】为了除去铁粉中的少量铝粉,可以选取下列哪种溶液( )
A.浓盐酸
B.浓硝酸
C.浓硫酸
D.氢氧化钠溶液
科目:高中化学 来源: 题型:
【题目】实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.1molL﹣1的盐酸进行滴定,完成下列问题: ①称取5.0g该氢氧化钠固体样品,配成500mL溶液备用;
②将标准盐酸装在酸式滴定管中,调节液面位置在“0”刻度以下,并记录下刻度;
③取25.00mL待测液.该项实验操作使用的主要仪器有(除锥形瓶外) , 用酚酞作指示剂时,滴定到溶液颜色由色刚好变成色为止;
④某同学根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000molL﹣1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理数据列出氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)= .
⑤由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是(填写编号)
A.中和滴定达终点时俯视滴定管内液面度数
B.碱式滴定管用蒸馏水洗净后立即取用25ml待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题.
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度. 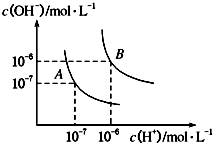
①100℃时1molL﹣1的NaOH溶液中,由水电离出的c(H+)=molL﹣1 , KW(25℃)KW(100℃)(填“>”、“<”或“=”).
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是(填“促进”、“抑制”或“不影响”).
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)c(CH3COO﹣)(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C和Si都属于第ⅣA族元素,下列有关说法正确的是( )
A. C和Si都是良好的导电材料B. CO2和SiO2常温下都呈气态
C. CH4和SiH4都是共价化合物D. H2CO3和H2SiO3都是二元强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 硫酸与氢氧化钡溶液反应:H++ OH-= H2O
B. 稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++ 3H2↑
C. 氯气通入水中:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
D. AlCl3溶液中加入足量的氨水:Al3++ 3NH3·H2O = Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.试回答下列问题: 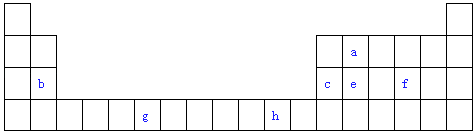
(1)写出元素g的基态原子电子排布式 .
(2)f在空气中燃烧产物的分子构型为 , 中心原子的杂化形式为 , 该分子是(选填“极性”、“非极性”)分子.
(3)由a原子跟e原子以1:1相互交替结合而形成的晶体,晶型与晶体e相同.两者相比熔点更高的是(填化学式),试从结构角度加以解释 .
(4)c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 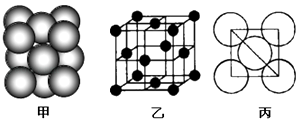
若已知c的原子半径为d厘米,NA代表阿伏伽德罗常数,c的相对原子质量为M,请回答:
①晶胞中c原子的配位数为 , 表示原子空间占有率的代数式为 .
②该晶体的密度为g/cm3(用含有关字母的代数式表示),b、h中,与c单质晶体中原子的堆积方式相同的是(填元素符号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:某一元氯代环烷烃A分子式为C6H11Cl,可以发生如图所示的转化: 
结构分析表明A分子中只含有一个甲基,A的核磁共振氢谱有五个峰,峰面积之比为1:1:2:3:4.A转化为B时生成的有机物只可能有一种.请回答下列问题:
(1)写出反应类型:C→E , E→G .
(2)写出结构简式:F , E .
(3)写出反应方程式:A→B , C→D .
(4)分子式和E相同,主链含有5个碳原子的二元羧酸的同分异构体有种(不考虑立体异构).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种原子序数依次增大的短周期元素.A与其余五种元素既不同周期,也不同主族;B、C、D、E、F五种元素分别位于五个相邻的主族,原子序数之和为54,其中B的单质为空气中的主要成分之一.
(1)A、B形成的化合物液态时可发生微弱电离,电离产生的阴离子的电子式为 .
(2)某含F的盐矿石的组成可以看作其氧化物中有 ![]() 的F被E替换,再由D平衡其电荷形成的.该矿石的化学式为 . (用氧化物形式表示)
的F被E替换,再由D平衡其电荷形成的.该矿石的化学式为 . (用氧化物形式表示)
(3)工业中制备单质E的阳极电极反应式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com