
科目: 来源: 题型:
【题目】X、Y、W、Z 是四种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知 W 的一种核素的质量数为 18,中子数为 10,X和Ne原子的核外电子总数相差 1;Y 的单质是一种常见的半导体材料; Z 的非金属性在同周期主族元素中最强。 下列说法正确的是( )

A. 最高化合价: X>Y>Z>W
B. 简单气态氢化物的稳定性: Z>Y>W
C. Y 的氧化物与 X、 Z 的最高价氧化物对应的水化物均能反应
D. 由 X、 Z、 W 三种元素形成的化合物一定既含有离子键又含共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是

A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C. 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA代表阿伏伽德罗常数,下列说法正确的是( )
A.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣ 个数为1 NA
B.标准状况下,11.2 L H2O 所含的分子数为0.5NA
C.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
D.18g H2O 和H2O2 的混合物含有的分子数为1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是工业海水提溴的部分流程,下列有关说法正确的是
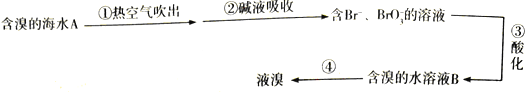
A. “吹出”采用热空气而不是常温空气的原因是热空气氧化性强
B. 碱液吸收所发生的化学反应中氧化剂与还原剂之比为1 : 5
C. 第③ 步中“酸化”要用强氧化性的酸,如硝酸
D. 含溴的水溶液B中的单质溴浓度比A中的大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.用石墨作电极电解饱和NaCl溶液:2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣
Cl2↑+H2↑+2OH﹣
B.向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+刚好沉淀完全:
Al3++SO42﹣+Ba2++3OH﹣═BaSO4↓+Al(OH)3↓
C.过量氯气通入溴化亚铁溶液中:2Cl2+2Fe2++2Br﹣═4Cl﹣+2Fe3++Br2
D.向氯化铝溶液通入过量的氨气:Al3++4OH﹣═AlO2﹣+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室中,对下列事故或药品的处理正确的是( )
A.温度计不慎打破,散落的水银应用硫粉处理后收集
B.酒精灯使用完后,应及时吹灭并盖上灯帽
C.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D.含硫酸的废液倒入水槽,用水冲入下水道
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组对2-溴丙烷与NaOH溶液发生的反应进行探究,实验装置如下(夹持和加热装置已略去):
实验步骤:
ⅰ.将圆底烧瓶用水浴加热,冷凝管中通入冷凝水;
ⅱ.将分液漏斗中的2-溴丙烷与NaOH溶液的混合液滴入圆底烧瓶内。
(1)水冷凝管a口是(填“进水口”或“出水口”)。
(2)取具支试管中收集到的液体,经红外光谱检测,其中一种物质中存在C-O键和O-H键。则该物质的结构简式是。
(3)实验中酸性KMnO4溶液褪色,生成该使酸性KMnO4溶液褪色的物质的反应的化学方程式是。
(4)通过该实验得到的结论是。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属镍具有较高的经济价值。工业上采用一定方法处理含镍废水使其达标排放并回收镍。某电镀废水中的镍主要以NiRz络合物形式存在,在水溶液中存在以下平衡: NiR2(aq) ![]() Ni2+(aq) +2R-(aq) (R-为有机物配体,K=1.6×10-14)
Ni2+(aq) +2R-(aq) (R-为有机物配体,K=1.6×10-14)
(1)传统的“硫化物沉淀法”是向废水中加入Na2S,使其中的NiR2 生成NiS 沉淀进而回收镍。
①该反应的离子方程式为_______________。
②NiS 沉淀生成的同时会有少量Ni(OH)2沉淀生成,用离子方程式解释Ni(OH)2生成的原因是______________。
(2)“硫化物沉淀法”镍的回收率不高,处理后废水中的镍含量难以达标。“铁脱络-化学沉淀法”可达到预期效果,该法将镍转化为Ni(OH)2固体进而回收镍。工艺流程如下:

“脱络”(指镍元素由络合物NiR2转化成游离的Ni3+) 过程中,R-与中间产物-OH (羟基自由基) 反应生成难以与Ni2+络合的-R (有机物自由基),但-OH也能与H2O2发生反应。反应的方程式如下:Fe2+ + H2O2 = Fe3+ +OH-+-OH i
R- +-OH =OH-+-R ii
H2O2+2-OH=O2↑+ 2H2O iii
实验测得“脱络”过程中H2O2的加入量对溶液中镍去除率的影响如图所示:

①从平衡移动的角度解释加入Fe2+和H2O2能够实现“脱络”的原因是______________。
②分析图中曲线,可推断过氧化氢的最佳加入量为_______________ g/ L; 低于或高于这个值,废水处理效果都下降,原因是____________。
(3) 工业上还可用电解法制取三氧化二镍。①用NaOH溶液调节NiCl2溶液PH至7.5,加入适量硫酸钠后采用情性电极进行电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。写出ClO- 氧化Ni (OH) 2生成三氧化二镍的离子方程式是______, amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是_________。
②电解法制取三氧化二镍实际过程中,有时获得一种结晶水合物,已知1mol 该物质中含有0.5mol结晶水。取该化合物20.2g进行充分加热,而获得三氧化二镍固体和0.2mol水,则该结晶水合物的化学式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com