
科目: 来源: 题型:阅读理解
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
查看答案和解析>>
科目: 来源: 题型:
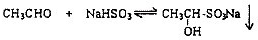
| 羰基化合物 | CH3CHO | CH3COCH3 | C2H5COCH3 | CH3CH2CH2COCH3 |
| 产率(1小时内) | 88.7 | 56.2 | 36.4 | 23.4 |
| 羰基化合物 | (CH3)2CHCOCH3 | (CH3)3CCOCH3 | C2H5COC2H5 | C6H5COCH3 |
| 产率(1小时内) | 12.3 | 5.6 | 2 | 1 |
| Cl2NaOH |
| NaOH |
| △ |
查看答案和解析>>
科目: 来源: 题型:
氢是重要而洁净的能源。要利用氢气做能源,必须解决好安全有效地储存氢气的问题,化学家研究出利用金属或合金来储存氢气的方法。金属是紧密堆积结构,结构中存在许多四面体和八面体空隙,氢原子可以填入空隙中而被储存起来,MgH2就是一种储氢材料。金属镁属六方晶系,晶胞结构如图所示(a=3.20×10-8cm,c=5.22×10-8cm),回答下列问题:
(1)每个晶胞含有 个镁原子。
(2)晶胞的体积是 g·cm-3。
(3)储氢材料MgH2表示2个H原子填入空隙中,假定Mg吸氢后体积不变,则MgH2中氢的密度是 。
(4)在标准状况下,1体积镁可储存 体积的氢气。
查看答案和解析>>
科目: 来源: 题型:
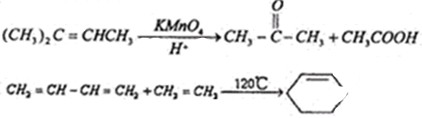
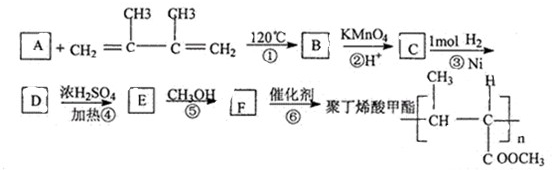
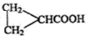 (任写2个)
(任写2个) (任写2个)
(任写2个)| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目: 来源: 题型:阅读理解

查看答案和解析>>
科目: 来源: 题型:阅读理解

| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 时间(min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 |
| O2 | 5 | 3.5 | 2.5 | 1.75 | 1 | 0.5 | 0.5 | 0.5 |
| SO3 | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 |
| 压强/MPa 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
科目: 来源: 题型:阅读理解
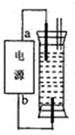 (2009?江门一模)某研究性学习小组设计了一个环保型消毒液发生器,如图所示装置,用一石墨作电极电解饱和NaCl溶液,请你完成以下实验探究过程:
(2009?江门一模)某研究性学习小组设计了一个环保型消毒液发生器,如图所示装置,用一石墨作电极电解饱和NaCl溶液,请你完成以下实验探究过程:
| ||
| ||
| 假设 | 实验操作 | 预期现象 | 结论 |
| ①有明显现象 | 用烧杯取少量消毒液,将一颗光亮的铁钉放入烧杯,浸泡一段时间 用烧杯取少量消毒液,将一颗光亮的铁钉放入烧杯,浸泡一段时间 |
铁定表面出现铁锈 铁定表面出现铁锈 |
铁定被锈蚀 铁定被锈蚀 |
| ②无明显现象,要进一步探究 | 用试管取少量(实验①)浸泡后的溶液,滴加足量的1mol/L的硫酸酸化,再用滴管滴加几滴20%的KSCN溶液 用试管取少量(实验①)浸泡后的溶液,滴加足量的1mol/L的硫酸酸化,再用滴管滴加几滴20%的KSCN溶液 |
溶液不变色或溶液显血红色 溶液不变色或溶液显血红色 |
铁钉可能未被腐蚀也可能被腐蚀 铁钉可能未被腐蚀也可能被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com