
科目: 来源: 题型:
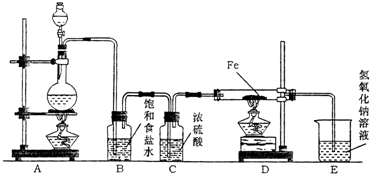 某研究性学习小组设计如图装置制取氯气并以氯气为原料进行实验.
某研究性学习小组设计如图装置制取氯气并以氯气为原料进行实验.
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
| 实验内容 | 实验现象 | 实验结论 |
(1)Na、Mg(条)、K与水反应 |
同一周期自左而右元素原子失电子的能力逐渐 减弱 减弱 ;同一主族自上而下元素原子失电子能力依次增强 增强 . | |
(2)Mg、Al与酸反应 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 实验 序号 |
铁的 质量/g |
铁的 形态 |
c/(H2SO4) /mol?L-1 |
V(H2SO4) /mL |
溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 铁片 | 0.7 | 50 | 20 | 36 | 250 |
| 2 | 0.10 | 铁片 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 铁粉 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 铁片 | 1.0 | 50 | 20 | 35 | 125 |
| 5 | 0.10 | 铁片 | 1.0 | 50 | 35 | 50 | 50 |
查看答案和解析>>
科目: 来源: 题型:
 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图所示:
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图所示:| Cu |
| △ |
| Cu |
| △ |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com