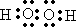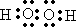温州市地处沿海,海水资源丰富,海水提取食盐和Br
2以后的盐卤可以用来制备纯净的MgCl
2或MgO.盐卤中含有Mg
2+、Cl
-,还含有少量Na
+、Fe
2+、Fe
3+、SO
42-和CO(NH
2)
2等.制备流程如图1:

(1)滤渣的成分是
Fe(OH)3、CaSO4
Fe(OH)3、CaSO4
(写化学式);滤液Ⅱ中所含主要的杂质离子是
Na+
Na+
(写离子符号).为了加快过滤速度,常采用减压过滤,写出组装减压过滤装置的主要硅酸盐仪器名称
布氏漏斗
布氏漏斗
,
抽滤瓶或吸滤瓶
抽滤瓶或吸滤瓶
.(写2种即可)
(2)用NaClO除去尿素CO(NH
2)
2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为
3NaClO+CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O
3NaClO+CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O
;加入NaClO的另一个作用是
将Fe2+氧化为Fe3+,并形成Fe(OH)3被除去.
将Fe2+氧化为Fe3+,并形成Fe(OH)3被除去.
.
(3)温度和压强P(HCl)
g对MgCl
2?6H
2O晶体热分解产物的影响如图2所示.请回答下列问题:
①写出P(HCl)
g=0.25MPa,温度从300℃升高到550℃时反应的化学方程式
Mg(OH)Cl=MgO+HCl↑
Mg(OH)Cl=MgO+HCl↑
;
②实际生产中,将MgCl
2?6H
2O晶体加热到600℃的过程中几乎得不到无水MgCl
2,其原因是
P(HCl)g较小,镁离子水解生成氢氧化镁,得不到氯化镁;通入HCl,而增大P(HCl)g
P(HCl)g较小,镁离子水解生成氢氧化镁,得不到氯化镁;通入HCl,而增大P(HCl)g
;若要得到无水MgCl
2须采取的措施是
通入HCl,而增大P(HCl)g,抑制镁离子的水解;
通入HCl,而增大P(HCl)g,抑制镁离子的水解;
.